本周为大家带来的文献为发表于Discov Oncol.(IF:2.8)的” ELFN1-AS1 promotes GDF15-mediated immune escape of colorectal cancer from NK cells by facilitating GCN5 and SND1 association”。本文使用了LabEx提供的抗体芯片检测服务。
结直肠癌(CRC)是消化系统中常见的恶性肿瘤之一,特别是在中国,其发病率和死亡率都显著较高,给全球公共卫生带来了巨大负担。CRC的转移性使其难以控制,导致五年生存率较低。在发生远处转移之前,肿瘤细胞必须逃避人体内的免疫监视,但结直肠癌免疫逃逸的机制仍不清楚。
越来越多的证据表明,长链非编码RNA(lncRNA)通过与miRNA、mRNA和蛋白质相互作用,调节与癌症转移相关的信号通路,如HOTAIR、AC020978和TMEM220-AS1等,展示了lncRNA在癌症中既具有抑癌基因功能,也具有致癌基因功能的双重特性。例如,lncRNA LINC01569通过与miR-381-3p竞争结合RAP2A,形成影响CRC癌细胞转移的复杂体;相反,LINC00675通过与波形蛋白相互作用,增强其Ser83的磷酸化,降低胃癌细胞的转移。此外,许多lncRNA也参与了癌细胞逃避免疫监视的过程,尽管其潜在机制尚不明确。
先天免疫反应是人体用于消除恶性细胞的初始屏障。在先天免疫细胞中,自然杀伤细胞(NK细胞)被认为是最具杀伤力的效应细胞。然而,在癌组织中,NK细胞的活性受到抑制,NK细胞的浸润不足与癌症患者的生存率密切相关。lncRNA也影响癌细胞逃避NK细胞免疫监视的能力。例如,lncRNA GAS5通过调节miR-544/RUNX3轴,增强NK细胞对肝癌细胞的细胞毒性能力。在CRC中,PTTG3P过表达促进M2型巨噬细胞的极化,而PTTG3P低表达则改变了NK、CD8+T细胞和TFH细胞的浸润。
ELFN1-AS1(ELFN1反义RNA1,又名MYCLo-2)是一种新发现的ELFN1反义lncRNA,在包括食管癌、卵巢癌和CRC在内的多种实体肿瘤中被认为具有致癌基因功能。ELFN1-AS1受MYC调控,在癌症的发生和转化中起重要作用。在CRC中,ELFN1-AS1通过调节miR-4644/Trim44轴被确认为促进结肠癌进展的因素,并通过海绵吸附miR-1250上调MTA1,从而促进细胞的侵袭、迁移和增殖。然而,ELFN1-AS1是否在CRC免疫逃逸中发挥作用尚不明确。在本研究中,研究者的发现表明ELFN1-AS1在NK细胞监视中起到抑制作用,并揭示了ELFN1-AS1导致NK细胞失活的潜在机制。
LabEx提供的抗体芯片检测服务
在ELFN1-AS1沉默的结直肠癌(CRC)细胞和对照组中,使用含有1% PMSF的RIPA裂解缓冲液提取总蛋白,并将其用于由上海乐备实生物技术有限公司(ARY003B)进行的信号通路阵列分析。
通路阵列分析显示,与ELFN1-AS1沉默的结直肠癌(CRC)细胞共培养后,NK细胞中多种蛋白的磷酸化水平增加(图3A)。其中,JNK信号通路已被报道可调控NKG2D的表达。
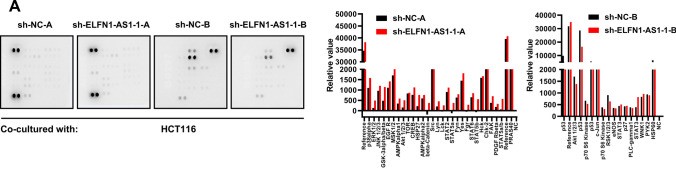
评估与HCT116细胞共培养的NK细胞中多种蛋白的磷酸化水平。
重要发现
研究者确定ELFN1-AS1增强了CRC细胞在体内和体外逃避NK细胞监视的能力。此外,研究者证实CRC细胞中的ELFN1-AS1通过GDF15/JNK通路下调NKG2D和GZMB,从而削弱了NK细胞的活性。进一步的机制研究表明,ELFN1-AS1增强了GCN5和SND1蛋白之间的相互作用,这影响了GDF15启动子处H3k9ac的富集,从而促进了CRC细胞中GDF15的产生。总之,研究者的研究结果表明,CRC细胞中的ELFN1-AS1抑制了NK细胞的细胞毒性,并且ELFN1-AS1是一个潜在的CRC治疗靶点。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


