|
肠道免疫
胃肠道(GI)被认为是人体中最大的免疫器官,在调节免疫稳态方面起着核心作用。胃肠道(GI)是人体与外界环境接触的最大界面,履行着食品加工的功能,在排除病原体的同时允许共生微生物生存。因此,胃肠道是一个主要的防线,其中上皮细胞提供物理屏障,并协同免疫和基质细胞抗击病原体,限制它们与上皮细胞的直接接触。

胃肠道可容纳人体淋巴细胞总数的70%,使其成为人体最大的免疫器官(图1)。固有层包含树突状细胞(DC),这是重要的APCs。以及内脏相关淋巴组织(GALT),包括派尔集合淋巴结(PP)和上皮内淋巴细胞(IELs)。PP在细菌负荷较大的回肠中更为常见,是重要的诱导位点,其中包含诱导抗原特异性反应所需的所有免疫反应细胞。微褶(M)细胞上有特殊的滤泡上皮细胞,能够将抗原从管腔中提取并运输到免疫器官。M细胞是一把双刃剑,因为它们介导抗原传递至粘膜淋巴组织以启动免疫反应,但也可以作为微生物的进入点。最后,适应性免疫系统通过分泌免疫球蛋白(Ig)等效应因子进入肠腔,对抗病原体附着和粘膜组织的入侵,从而促进肠道屏障防御。

图1.小肠粘膜、绒毛、利伯库恩隐窝和细胞。
小肠的肠壁被高度折叠以最大限度地吸收,并包含指状的粘膜突出物,形成绒毛,绒毛向下凹陷形成隐窝,向下延伸至粘膜肌层。在上皮的下面,固有层中包含树突状细胞,这是重要的抗原呈递细胞,调节体液和细胞肠道免疫。外肌层包含两层平滑肌,使小肠能够持续蠕动。左侧为隐窝上皮和部分绒毛,可分辨出不同的上皮细胞:肠上皮细胞,顶端表面刷状边界的高柱状吸收细胞,称为微绒毛; 分泌粘蛋白的杯状细胞,润滑肠内容物,保护上皮; 分泌各种肠道激素的肠内分泌细胞; 位于隐窝底部附近的干细胞,形成专门的上皮细胞; 干细胞的上面是过渡-扩增细胞;Paneth细胞,有防御功能,分泌抗菌分子进入管腔。
免疫机制
固有免疫
肠道固有免疫,也叫先天免疫,是一种非特异性的免疫反应,是机体与生俱来的抵抗病原微生物入侵的能力,是机体的第一道防线,也是适应性性免疫的基础。由免疫细胞和免疫分子组成。
固有免疫细胞包括:肠上皮细胞,M细胞,中性粒细胞,单核巨噬细胞,DC细胞,NK细胞,等等。
适应性免疫 肠道的适应性免疫是特异性免疫系统,主要有免疫细胞包括肠道相关的淋巴细胞以及免疫分子组成。
T细胞
CD4+ T细胞主要位于肠道LP中,多为效应T细胞或记忆T细胞。CD4+ T细胞的应答因肠道菌群的定植生态位、抗原类型和代谢特性而有很大差异,这导致了不同T细胞亚群的产生和某些T细胞亚群的功能可塑性。经过微生物群的激活,抗原呈递细胞(APCs) 呈递,如树突状细胞(DC),CD4+ T细胞分别分化为Tregs和各种T辅助细胞(Th)。已有研究表明,丁酸通过不同程度地调节Th1和Th17细胞分化以及促进IL-10的产生来控制T细胞在诱导结肠炎中的能力。
Th17产生的IL-17A,IL-17F和IL-22依次刺激IECs产生抗菌肽(AMP),并以非炎性的方式维持肠屏障的完整性。此外,Th17细胞对于T细胞依赖性(TD)高亲和力细菌特异性IgA的生产至关重要。
肠源性Foxp3 + Treg细胞不同于其他器官,具有肠道特异性表型和功能。
Tfh细胞的消融导致PPs,GC B细胞数量减少,并显着改变肠道微生物组的组成。因此,Tfh细胞活性对于肠道中多种微生物群落的产生很重要。Tfh细胞在PPs中产生的IL-21对于驱动小肠中的GC反应和高亲和性sIgA产生至关重要。
在稳定状态下,粘膜适应性免疫细胞,特别是Tregs和Tfh,以及sIgA与IEC,DC和ILC协同作用,有助于肠道生态环境的耐受性状态,维持肠道稳态以及宿主与微生物群之间的相互关系。保持引起对传染原有效的免疫反应的能力(图2)。
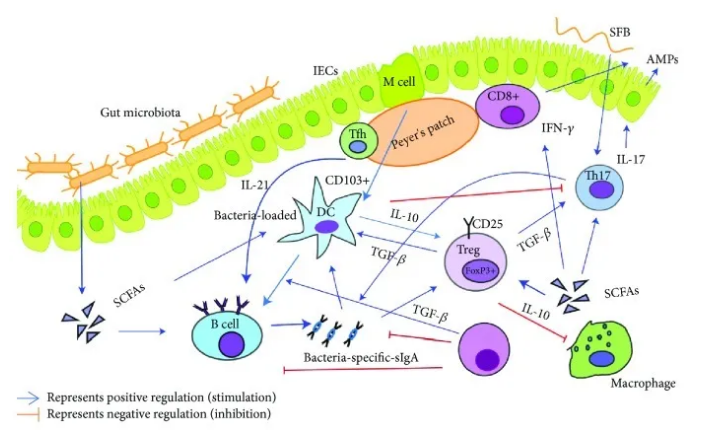
肠道菌群调节肠道粘膜适应性免疫和免疫细胞之间的相互作用。肠道微生物群,他们的组成部分,和代谢物可以调节先天和适应性免疫反应从而维持稳态和失调状态。在稳态条件下,微生物群和微生物代谢产物通过Treg和sIgA促进肠道免疫耐受。DC有助于通过IL-10分泌诱导Treg和sIgA的产生。细菌成分(例如SCFAs)是Tregs和B细胞的有效诱导剂,并促进CD8 +产生IFN- γT细胞。PP中Tfh分泌的SCFA和IL-21有助于细菌特异性sIgA的分泌。分段丝状细菌诱导SFB特异性Th17细胞产生。Treg通过TGF- β介导调节DC和Th17细胞。DC和sIgA负调节Th17细胞的功能。
产品推荐: 多因子技术可一次检测多个样本的多个指标,产品多多欢迎关注~
| 种属 |
检测方向 |
货号 |
检测因子 |
| Human |
Chemokine |
LX-171AK99MR2 |
6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GM-CSF,Gro-α /CXCL1,Gro-β/CXCL2,I-309/CCL1,IFN-I,IL-18,IL-2,IL-4,IL-6,IL-8/CXCL 8,IL-10,IL-16,IP-10/CXCL 10,I-TAC /CXCL11,MCP-1 /CCL2,MCP-2 /CCL8,MCP-3 /CCL7,MCP-4 /CCL13,MDC/CCL 22,MIF,MIG/CXCL19,MIP-1α/CCL3,MIP-1δ/CCL15,MIP-3a/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SCYB16/CXCL 16,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25,TNF-α |
| Human |
Cytokine/ Th1/Th2 |
LX-M5000005L3 |
GM-CSF, IFN-γ, IL-2, IL-4, IL-5, IL-10, IL-12 (p70), IL-13, TNF-α |
| Human |
Chemokine |
LX-LKTM012 |
CCL2/JE/MCP-1,CCL3/MIP-1 alpha,CCL4/MIP-1 beta,CCL5/RANTES,CCL11/Eotaxin,CXCL1/GRO alpha/KC/CINC-1,CXCL10/IP-10/CRG-2,IL-8/CXCL8 |
| Human |
Cytokine/Chemokine |
LX-HCYTOMAG-60K-41 |
EGF,Eotaxin/CCL11,FGF-2/FGF-basic,Flt3 Ligand,Fractalkine/CX3CL1,G-CSF,GM-CSF,GRO,IFNα2,IFNγ,IL-1α,IL-1β,IL-1Ra,IL-2,IL-3,IL-4,IL-5 ,IL-6,IL-7,IL-8/CXCL8,IL-9,IL-10,IL-12 (p40),IL-12 (p70),IL-13,IL-15,IL-17A/CTLA8,IP-10/CXCL10,MCP-1/CCL2,MCP-3/CCL7,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,PDGF-AA,PDGF-AB/BB,RANTES/CCL5,TGFα,TNFα,TNFβ/Lymphotoxin-α(LTA),VEGF-A |
| Human |
Cytokine/Chemokine |
LX-HCYP2MAG-62K-23 |
6Ckine/CCL21/Exodus-2,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin-2/CCL24/MPIF-2,Eotaxin-3/CCL26,I-309/CCL1,IL-16,IL-20,IL-21,IL-23,IL-28A/IFNλ2,IL-33/NF-HEV(mature),LIF,MCP-2/CCL8,MCP-4/CCL13,MIP-1δ/MIP-5/CCL15,SCF,SDF-1/CXCL12,TARC/CCL17,TPO,TRAIL/TNFSF10, TSLP |
| Human |
Cytokine/Chemokine |
LX-HCYP3MAG-63K-11 |
HCC-1/CCL14,IL-11,IL-29/IFNλ1,I-TAC/CXCL11,LIX/CXCL6/GCP-2,Lymphotactin/XCL1,M-CSF,MIG/CXCL9,MIP-3α/CCL20,MIP-3β/CCL19,NAP-2/CXCL7 |
| Human |
Cytokine/Chemokine |
LX-HCYP4MAG-64K-20 |
BAFF/Blys,BRAK/CXCL14,CCL28,CXCL16,HCC-4/CCL16,HMGB1,IFNβ,IL-14/α-Taxilin,IL-19,IL-24,IL-28B/IFNλ3,IL-32α,IL-34,IL-35, IL-36β/IL-1F8,IL-37/IL-1F7,IL-38/IL-1F10,MIP-4/PARC/CCL18,MPIF/CCL23,YKL40/CHI3L1 |
|














 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


