|
炎症(inflammation):就是平时人们所说的“发炎”,是机体对于刺激的一种防御反应,表现为红、肿、热、痛和功能障碍。炎症,可以是感染引起的感染性炎症,也可以不是由于感染引起的非感染性炎症。通常情况下,炎症是有益的,是人体的自动的防御反应,但是有的时候。炎症也是有害的,例如对人体自身组织的攻击、发生在透明组织的炎症等等。
 病因 病因
生物性因子
细菌、病毒、立克次体、支原体、真菌、螺旋体和寄生虫等为炎症最常见的原因。由生物病原体引起的炎症又称感染(infection)。细菌产生的外毒素和内毒素可以直接损伤组织;病毒在被感染的细胞内复制导致细胞坏死;某些具有抗原性的病原体感染后通过诱发的免疫反应而损伤组织,如寄生虫感染和结核。
物理性因子
高温、低温、放射性物质及紫外线等和机械损伤。
化学性因子
外源性化学物质如强酸、强碱及松节油、芥子气等。内源性毒性物质如坏死组织的分解产物及在某些病理条件下堆积于体内的代谢产物如尿素等。
坏死组织
缺血或缺氧等原因可引起组织坏死,组织坏死是潜在的致炎因子。在新鲜梗死灶边缘所出现的充血出血带和炎性细胞的浸润都是炎症的表现。

常见疾病
疾病及相关研究
肺炎与肺炎链球菌
肺炎是肺实质中导致肺功能异常的急性感染,是住院期间最常见的感染。根据病原体的差异,肺炎也可分为典型或非典型类型。肺炎的典型类型通常由链球菌(Spn)和葡萄球菌等细菌引起,而非典型性类型则由流感病毒,支原体,衣原体,军团菌,腺病毒或其他未鉴定的微生物引起。 呼吸道炎症失调和破坏的呼吸系统疾病是开始感染Spn细菌的重要危险因素。

Spn共生定殖向疾病的过渡。由流感病毒或慢性病(如COPD或过敏性哮喘)引起的急性或慢性气道炎症会促进Spn细菌的生长并损害呼吸道组织的屏障功能,从而导致Spn细菌侵入血液,从而形成侵袭性感染。彩色圆点(绿色,黄色,红色,蓝色)代表趋化因子和细胞因子[1]。
肺炎中的生物标志物可分为四类[2]:
(1)微生物及其衍生物;
(2)炎症介质;
(3)炎症反应蛋白;
(4)压力感应蛋白

幽门螺旋杆菌与胃炎及其他疾病
幽门螺杆菌是一种革兰氏阴性细菌,其在被感染个体的胃中的存在与几种胃部疾病如慢性胃炎的发展有关。
在幽门螺杆菌感染中,细菌和宿主的适应性是非常相关的。宿主基因可能会影响幽门螺杆菌感染相关的病理进展。事实上,特定的多态性基因编码细胞因子, IL-1β, IL-8, IL-10 和TNF-α,,与增加促炎症反应,胃癌的风险增加有关。此外,先天免疫基因的多态性,如toll样受体4 (TLR4),也与此相关,因为TLR4被认为是胃上皮细胞中负责幽门螺杆菌诱导信号转导的受体。肿瘤抑制基因(如LOX、HAND1和APC)启动子区域的高甲基化引起的表观遗传变化,以及microRNAs (miRs)的改变和解除调节与幽门螺杆菌感染后胃癌的高患病率相关。
除胃部疾病以外,幽门螺旋杆菌感染对其他疾病也同样会产生影响。

幽门螺杆菌与其他疾病的关系。绿色方块表示幽门螺杆菌(H. pylori)与疾病呈正相关,红色方块表示幽门螺杆菌与疾病呈负相关。多发性硬化症用红色和绿色表示,有信息表明两者呈正相关和负相关[3]。
炎症过程中产生的许多潜在相关分子,例如细胞因子,趋化因子,自由基(ROS和NOS),前列腺素,生长因子和基质金属蛋白酶。

幽门螺杆菌通过注入毒力因子CagA和肽聚糖(PGN )诱导NF-κB活化,促进促炎反应,从而增加细胞因子(IL-1β,IL-8)的表达。和诱导型一氧化氮合酶(iNOS)。后者产生一氧化氮(NO)炎症介质。此外,幽门螺杆菌相关的NF-κB激活促进了miR-155表达,miR-155是一种与胃部疾病相关的microRNA。B:除了幽门螺杆菌的直接作用在胃上皮细胞上的感染会激活巨噬细胞,从而增加胃上皮细胞的NO产生和NO水平。NO可以激活DNA甲基转移酶1(宿主DNMT1),以促进多个基因启动子区域的DNA甲基化。C:幽门螺杆菌DNA甲基转移酶(Hp DNMT)还可直接促进宿主基因在一些基因的启动子区域中的甲基化,这些基因被认为在胃癌中起着抑癌作用。此外,感染与启动子甲基化和miR210的表达降低有关。
炎症性肠病
IBDs是慢性肠道免疫疾病,包括克罗恩病(CD)和溃疡性结肠炎(UC)。两种疾病的全球发病率在过去几十年不断增加,并成为一个重要的社会和经济负担。
环境触发因素可通过其对微生物组的影响来介导IBD发病机制。然而,为了使微生物改变导致不适当的和持续的炎症,肠屏障的分离腔和粘膜完整性也应该受到损害
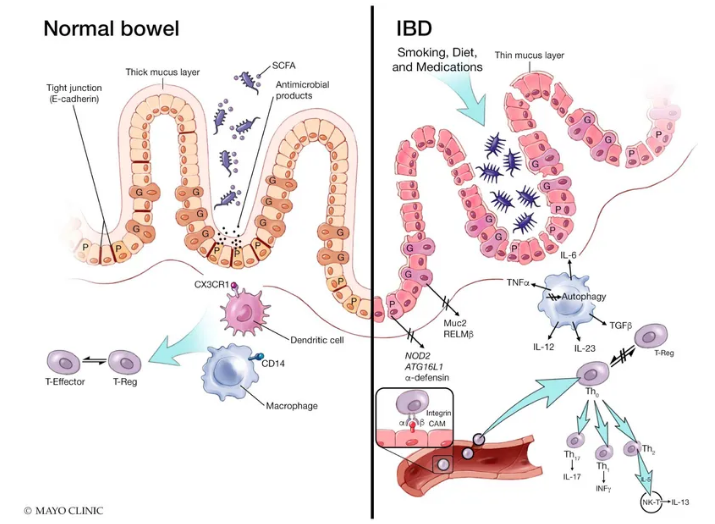
肠粘膜在正常肠和IBD中[4]。暴露于环境因素后,IBD患者会发生微生物营养不良,同时产生短链脂肪酸(SCFA)的细菌减少,而变形杆菌增加。维持肠屏障的机制在IBD粘膜中也被破坏,包括:紧密连接中E-钙粘蛋白的下调;粘液层的厚度;杯状细胞功能异常,包括Muc2和RELMβ蛋白;与Paneth细胞功能异常有关的机制,包括抗菌产物NOD2和ATG16L1的分泌基因相关功能。从先天免疫系统的角度来看,IBD粘膜已显示出:表达CD14的结肠巨噬细胞减少,树突状细胞的缺陷性CX3CR1抗原呈递;和自噬受损。最后,虽然在正常粘膜中也发生了通过整联蛋白细胞粘附分子(CAMs)相互作用引起的白细胞迁移,但在IBD粘膜中效应子和调节性T细胞(T-reg)之间的平衡似乎受到了干扰,导致不同T的激活不受控制。-细胞谱系迁移到发炎的肠道。
相关的生物标志物包括:
(1)肠道微生物因子:
肠道菌群可能受到饮食,益生菌,益生元,抗生素,外源酶,粪便菌群移植和其他环境因素的影响
(2)免疫相关:
肠道菌群驱动炎症的扩大,大量细胞浸润固有层,包括T细胞、B细胞、巨噬细胞、树突状细胞(DCs)和中性粒细胞;活化的固有层细胞产生高水平局部组织促炎细胞因子,包括TNF,IL-1β,IFN- γ和IL-23 / Th17细胞途径。
(3)炎症介质:
如自由基、白三烯,趋化因子和促炎细胞因子(如 IL-12, IL-23, IL-17, IL-18和TGF-β)等。
心肌炎
临床上,心肌炎占非缺血性病因心力衰竭的9例病例中的约1例,并且仍然是全世界心脏移植的最常见原因之一。心肌炎是最经常被用病毒感染引起的,但其他感染性病原体也可以参与,例如细菌和锥虫。
病毒进入后,由病毒复制引起的心肌细胞急性损伤导致心肌细胞坏死,细胞内抗原(例如心肌肌球蛋白)暴露和宿主免疫系统激活,其特征是自然杀伤细胞和巨噬细胞的入侵通过T淋巴细胞。心肌炎的急性期仅需几天。在病毒引起的损伤的急性期之后,第二阶段的特征是(自身)免疫反应。此亚急性期涵盖数周至数月,由活化的病毒特异性T淋巴细胞定义,该T淋巴细胞可通过分子模拟作用靶向宿主器官。细胞因子激活(TNF-α,IL -1和IL-6)以及抗病毒和心脏蛋白的抗体可能加重心脏损害并导致收缩功能受损。在大多数患有心肌炎的患者中,随着病毒的消除,免疫反应下降,并且左心室(LV)功能恢复而没有后遗症。但是,在某些鼠类模型中以及可能在患者中,(自身)免疫过程持续存在,与心肌中病毒基因组的检测无关,并导致慢性期,其特征是心肌重塑和DCM的发展。
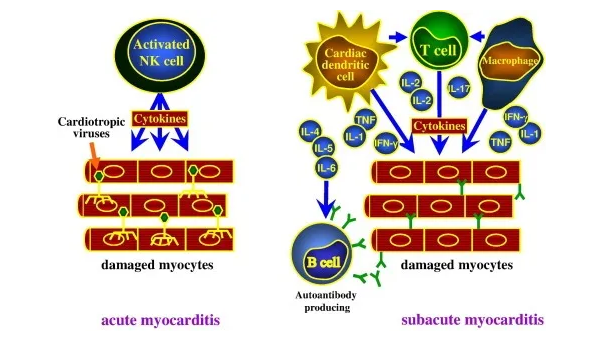
病毒性心肌炎的病理生理学[5]:病毒进入后,病毒复制会导致心肌细胞急性损伤(急性心肌炎)和宿主免疫系统活化(亚急性心肌炎)。IFN = 干扰素; IL =白介素; TNF =肿瘤坏死因子。
相关指标
心肌炎免疫机制的分析可以在三个不同阶段进行。a致病性自身免疫,b心肌发炎,c进展为扩张型心肌病。这三个阶段的每个阶段都有一个细胞因子标记。

败血症
败血症不仅是全身性炎症反应或免疫失调的过程,而且还涉及体内多个器官功能的改变。如图所示在细胞和分子水平上,败血症的发病机理极为复杂,包括炎症反应失衡,免疫功能异常,线粒体损伤,凝血病,神经内分泌免疫网络异常,内质网应激,自噬和其他病理生理过程,最终导致器官功能障碍。

败血症的复杂发病机制[6]。
炎症失衡是败血症发病机理的最关键基础,并贯穿败血症的整个过程,引起这种反应的病原体包括细菌,真菌,寄生虫和病毒等生物。主机的最初的急性响应于病原体侵入通常会导致巨噬细胞吞噬的病原体和产生一系列促炎细胞因子的,并且这可以触发细胞因子风暴和激活先天免疫系统。 先天免疫系统的激活是由模式识别受体(PRR)介导的,其通过检测损伤相关分子模式(DAMP)或病原体相关分子模式(PAMP)来启动免疫细胞的一系列激活,并且因此上调了炎症相关基因的表达。在对败血症的免疫反应中,源自病原体的外源因子,例如脂多糖(LPS)和受伤细胞释放的内源性因子,例如高迁移率族box-1(HMGB-1)蛋)都可以与各种的PRR,如Toll样受体(TLR),C型凝集素受体(CLR),RIG-I样受体(RLRS)和NOD样受体(NLRS)。在这些受体中,TLR的研究最为广泛。
相关指标包括:
(1)感染相关生物标志物:降钙素原(PCT)、C反应蛋白(CRP)、细胞因子(TNF-α/ IL-6)。
(2)与炎症激活和免疫失衡有关的生物标志物:单核细胞趋化蛋白-1(MCP-1)、程序性死亡受体1和程序性死亡配体1(PD-1 / PD-L1)、在髓样细胞-1(sTREM-1)上表达的可溶性触发受体、补体通路、中性粒细胞表面受体(CD64)。
(2)与器官功能障碍有关的生物标志物:血管生成素(Ang)、基质金属蛋白酶(MMP)。
研究指标推荐:更多信息,请联系我们~
| 种属 |
检测技术 |
检测方向 |
货号 |
因子数 |
检测因子 |
| Human |
MSD |
Viral Infection |
LX-K15345D-1 |
4 |
IL-1β, IL-6, IL-8, TNF-α |
| Human |
MSD |
Viral Infection |
LX-K15346D-1 |
7 |
IFN-γ, IL-1β, IL-4, IL-6, IL-8, IL-10, TNF-α |
| Human |
MSD |
Viral Infection |
LX-K15347D-1 |
9 |
IFN-γ, IL-1β, IL-4, IL-5, IL-6, IL-8, IL-10, IL-12p70, TNF-α |
| Human |
Luminex |
Sepsis |
LX-HSP1MAG-63K-06 |
6 |
sFAS / TNFRSF6,sFasL,sICAM-1,MIF,PAI-1 (total),sVCAM-1 |
| Human |
Luminex |
Sepsis |
LX-HSP2MAG-63K-07 |
7 |
Granzyme B,HSP70,IL-1α,IL-8/CXCL8,MIP-1α/CCL3,MIP-1β/CCL4,MMP-8 |
| Human |
Luminex |
Sepsis |
LX-HSP3MAG-63K-05 |
5 |
Lactotransferrin (LTF),Neutrophil Elastase-2(ELA2),NGAL/Lipocalin-2,Resistin,Thrombospondin-1(TSP-1) |
| Human |
Luminex |
Cytokine |
LX-12007283 |
48 |
FGF-basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-1α, IL-2Rα, IL-3, IL-12(p40), IL-16, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, GRO-α, HGF, IFN-α2, LIF, MCP-3, IL-10, IL-12(p70), IL-13, IL-15, IL-17, IP-10, MCP-1(MCAF), MIG, β-NGF, SCF, SCGF-β, SDF-1α, MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF, CTACK, MIF, TRAIL, IL-18, M-CSF, TNF-β |
| Human |
Luminex |
Chemokine |
LX-171AK99MR2 |
40 |
6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GM-CSF,Gro-α /CXCL1,Gro-β/CXCL2,I-309/CCL1,IFN-I,IL-18,IL-2,IL-4,IL-6,IL-8/CXCL 8,IL-10,IL-16,IP-10/CXCL 10,I-TAC /CXCL11,MCP-1 /CCL2,MCP-2 /CCL8,MCP-3 /CCL7,MCP-4 /CCL13,MDC/CCL 22,MIF,MIG/CXCL19,MIP-1α/CCL3,MIP-1δ/CCL15,MIP-3a/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SCYB16/CXCL 16,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25,TNF-α |
| Human |
Luminex |
Cytokine |
LX-M500KCAF0Y |
27 |
FGF basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12(p70), IL-13, IL-15, IL-17, IP-10, MCP-1(MCAF), MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF |
| Mouse |
Luminex |
Chemokine |
LX-12009159 |
31 |
BCA-1/CXCL13, CTACK/CCL27, ENA-78/CXCL5, Eotaxin/CCL11, Eotaxin-2/CCL24, Fractalkine/CX3CL1, GM-CSF, I-309/CCL1, IFN-γ, IL-1β, IL-2, IL-4, IL-6, IL-10, IL-16, IP-10/CXCL10, I-TAC/CXCL11, KC/CXCL1, MCP-1/CCL2, MCP-3/CCL7, MCP-5/CCL12, MDC/CCL22, MIP-1α/CCL3, MIP-1β/CCL4, MIP-3α/CCL20, MIP-3β/CCL19, RANTES/CCL5, SCYB16/CXCL16, SDF-1α/CXCL12, TARC/CCL17, TNF-α |
| Mouse |
Luminex |
Cytokine |
LX-M60009RDPD |
23 |
IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12 (p40), IL-12 (p70), IL-13, IL-17A, Eotaxin, G-CSF, GM-CSF, IFN-γ, KC, MCP-1 (MCAF), MIP-1α, MIP-1β, RANTES, TNF-α |
| Rat |
Luminex |
Cytokine |
LX-12005641 |
23 |
G-CSF, GM-CSF, GRO/KC, IFN-γ, IL-1α, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, IL-10, IL-12(p70), IL-13, IL-17A, IL-18, M-CSF, MCP-1, MIP-1α, MIP-3α, RANTES, TNF-α, VEGF |
| Human |
MSD |
Cytokines |
LX-K15050D-1 |
10 |
GM-CSF, IL-1α, IL-5, IL-7, IL-12/IL-23p40, IL-15, IL-16, IL-17A, TNF-β, VEGF-A |
参考文献
[1]Ifrah Sohail, Sumit Ghosh, Santhosh Mukundan, Susan Zelewski, M. Nadeem Khan. Role of Inflammatory Risk Factors in the Pathogenesis of Streptococcus pneumoniae. Front Immunol. 2018; 9: 2275. doi: 10.3389/fimmu.2018.02275
[2]Cheng CW, Chien MH, Su SC, Yang SF. New markers in pneumonia. Clin Chim Acta. 2013 Apr 18;419:19-25. doi: 10.1016/j.cca.2013.01.011. Epub 2013 Feb 4.
[3]Helicobacter pylori in human health and disease: Mechanisms for local gastric and systemic effects.Denisse Bravo, Anilei Hoare, Cristopher Soto, Manuel A Valenzuela, Andrew FG Quest. World J Gastroenterol. 2018 Jul 28; 24(28): 3071–3089. doi: 10.3748/wjg.v24.i28.3071
[4]Guilherme Piovezani Ramos , Konstantinos A Papadakis. Mechanisms of Disease: Inflammatory Bowel Diseases. Mayo Clin Proc. 2019 Jan;94(1):155-165. doi: 10.1016/j.mayocp.2018.09.013.
[5]Kindermann I, Barth C, Mahfoud F, Ukena C, Lenski M, Yilmaz A, Klingel K, Kandolf R, Sechtem U, Cooper LT, Böhm M.Update on myocarditis.J Am Coll Cardiol. 2012 Feb 28;59(9):779-92.doi: 10.1016/j.jacc.2011.09.074.
[6]Min Huang, Shaoli Cai, Jingqian Su.The Pathogenesis of Sepsis and Potential Therapeutic Targets. Int J Mol Sci. 2019 Nov; 20(21): 5376. doi: 10.3390/ijms20215376.
|
