|
树突状细胞(Dendritic cells, DC)是机体功能最强的专职抗原递呈细胞(Antigen presenting cells, APC),因其成熟时伸出许多树突样或伪足样突起而得名。是先天免疫和适应性免疫之间的关键介体,它能高效地摄取、加工处理和递呈抗原,未成熟DC具有较强的迁移能力,成熟DC能有效激活初始T细胞,处于启动、调控、并维持免疫应答的中心环节。
分化途径
DC起源自骨髓多能造血干细胞,分化主要有两条途径:①髓样干细胞在 GM-CSF的刺激下分化为DC,称为髓样DC(myeloid dendritic cells,MDC),也称DC1,与单核细胞和粒细胞有共同的前体细胞:②来源于淋巴样干细胞,与T细胞和NK细胞有共同的前体细胞,称为淋巴样DC(Lymphoid dendritic cells,LDC)或浆细胞样DC(plasmacytoid dendritic cells,pDC),即DC2。
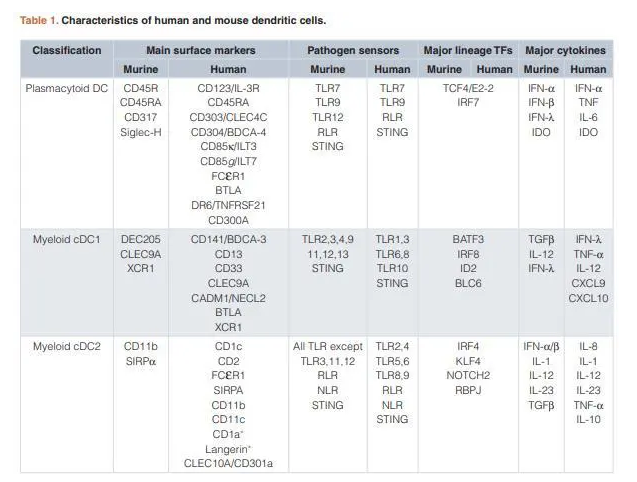
DC, dendritic cell; TF, transcription factor; cDC, conventional dendritic cell.
趋化因子与定位
DC的大多数前体离开骨髓,进入循环,定位于淋巴和非淋巴组织。在稳态和炎症状态下,常驻的外周组织DC通过淋巴系统到达引流淋巴结,并与T淋巴细胞相互作用。人的pDCs通常只存在于循环及淋巴器官中,它们可能以cxcr4依赖和ChemR23/ cmklr1依赖的方式定位。在病理条件下,pDCs通过可能依赖于CXCR4、CXCR3和CMKLR1表达的机制定位于外周组织,包括皮肤、一些肿瘤和动脉粥样硬化性主动脉。在稳态和炎症条件下的小鼠中,CCR2、CCR5和CCR9等趋化因子受体调节pDCs向淋巴和非淋巴器官(如小肠和皮肤)的迁移。为了通过这种不同的迁移路线,DC改变趋化因子受体的表达,以响应趋化梯度,引导它们到达正确的位置。

前体cDC(pre-cDC),pDC和单核细胞的前体在骨髓中分化,并通过血流以不同程度分布到淋巴器官(例如胸腺,脾脏和淋巴结),和非淋巴器官(例如皮肤,其中单核细胞和前体cDC可以分化为未成熟的DC)。这些细胞中的一些可以从次级淋巴器官通过传出的淋巴管和胸导管或脾静脉重新进入血液循环。b. 在非淋巴器官(例如皮肤)中,未成熟的DC经历自发的成熟程序,变成半成熟的DC,或者被病原体相关的分子模式激活并分化为成熟的DC。成熟和半成熟DC的CC趋化因子受体7(CCR7)表达升高,并向表达CCR7配体CC趋化因子配体21(CCL21)的末端淋巴管迁移。CCR7与CCL21的相互作用使DC进入淋巴管系统,并最终通过淋巴流向引流淋巴结的囊下窦(SCS)被动转运。在SCS内,CCL21被非典型趋化因子受体4(ACKR4)清除,该受体由SCS上限的淋巴内皮细胞特异性表达。这会产生一个指向T细胞区域的CCL21梯度,从而允许淋巴来源的DC有效而定向地迁移到该区域。
 
DC与免疫
DC是先天性免疫细胞,因为它们识别并响应病原体相关和危险相关信号,从而形成急性炎症反应。它们在适应性免疫中的决定性作用是加工细胞外和细胞内蛋白,并在MHC分子的作用下将抗原呈递给初免T细胞。

(a)在T细胞分化图中,DC作为单一的全能细胞,但每个亚群都是特异性的,以对病原体或危险信号作出特定反应。根据不同的背景,可以观察到许多不同的反应,并描述了人类浆细胞样DC (pDC)、常规DC1 (cDC1)和cDC2的主要功能。(b)造血干细胞(HSC)通过干扰素调节因子8 (IRF8)和IRF4相对表达的不同途径,分化为DC细胞和单核细胞源性细胞,如图所示。单核细胞的IRF4/8表达低,但可以被诱导分化为单核细胞来源的DC (mo DC)。
产品推荐
单/多因子检测
| 种属 |
检测方向 |
货号 |
检测因子 |
| Human |
Chemokine |
LX-171AK99MR2 |
6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GM-CSF,Gro-α /CXCL1,Gro-β/CXCL2,I-309/CCL1,IFN-I,IL-18,IL-2,IL-4,IL-6,IL-8/CXCL 8,IL-10,IL-16,IP-10/CXCL 10,I-TAC /CXCL11,MCP-1 /CCL2,MCP-2 /CCL8,MCP-3 /CCL7,MCP-4 /CCL13,MDC/CCL 22,MIF,MIG/CXCL19,MIP-1α/CCL3,MIP-1δ/CCL15,MIP-3a/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SCYB16/CXCL 16,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25,TNF-α |
| Human |
Cytokine Th1/Th2 |
LX-M5000005L3 |
GM-CSF, IFN-γ, IL-2, IL-4, IL-5, IL-10, IL-12 (p70), IL-13, TNF-α |
| Human |
Inflammation |
LX-171AL001M |
APRIL/TNFSF13, BAFF/TNFSF13B, sCD30/TNFRSF8, sCD163, Chitinase-3-like-1, gp130/sIL-6Rβ, IFN-α2, IFN-β, IFN-γ,IL-2, sIL-6Rα, IL-8, IL-10, IL-11, IL-12(p40), IL-12(p70), IL-19, IL-20, IL-22, IL-26, IL-27(p28), IL-28A/IFN-λ2, IL-29/IFN-λ1, IL-32, IL-34, IL-35, LIGHT/TNFSF14, MMP-1, MMP-2, MMP-3, Osteocalcin, Osteopontin, Pentraxin-3, sTNF-R1, sTNF-R2, TSLP, TWEAK/TNFSF12 |
| Human |
Treg cytokines |
LX-171AL003M |
IL-2,IL-10,IL-12 (p40),IL-12 (p70),IL-19,IL-20,IL-22,IL-26,IL-27 (p28),IL-28A / IFN-λ2,IL-29 / IFN-λ1,IL-35 |
| Human |
Chemokine |
LX-LKTM012 |
CCL2/JE/MCP-1,CCL3/MIP-1 alpha,CCL4/MIP-1 beta,CCL5/RANTES,CCL11/Eotaxin,CXCL1/GRO alpha/KC/CINC-1,CXCL10/IP-10/CRG-2,IL-8/CXCL8 |
| Human |
Chemokine |
LX-K15047D-1 |
Eotaxin, Eotaxin-3, IL-8,, IP-10, MCP-1, MCP-4, MDC, MIP-1α, MIP-1β, TARC |
| Human |
Cytokine/Chemokine |
LX-HCYTOMAG-60K-41 |
EGF,Eotaxin/CCL11,FGF-2/FGF-basic,Flt3 Ligand,Fractalkine/CX3CL1,G-CSF,GM-CSF,GRO,IFNα2,IFNγ,IL-1α,IL-1β,IL-1Ra,IL-2,IL-3,IL-4,IL-5 ,IL-6,IL-7,IL-8/CXCL8,IL-9,IL-10,IL-12 (p40),IL-12 (p70),IL-13,IL-15,IL-17A/CTLA8,IP-10/CXCL10,MCP-1/CCL2,MCP-3/CCL7,MDC/CCL22,MIP-1α/CCL3,MIP-1β/CCL4,PDGF-AA,PDGF-AB/BB,RANTES/CCL5,TGFα,TNFα,TNFβ/Lymphotoxin-α(LTA),VEGF-A |
| Human |
Cytokine/Chemokine |
LX-HCYP2MAG-62K-23 |
6Ckine/CCL21/Exodus-2,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin-2/CCL24/MPIF-2,Eotaxin-3/CCL26,I-309/CCL1,IL-16,IL-20,IL-21,IL-23,IL-28A/IFNλ2,IL-33/NF-HEV(mature),LIF,MCP-2/CCL8,MCP-4/CCL13,MIP-1δ/MIP-5/CCL15,SCF,SDF-1/CXCL12,TARC/CCL17,TPO,TRAIL/TNFSF10, TSLP |
| Human |
Cytokine/Chemokine |
LX-HCYP3MAG-63K-11 |
HCC-1/CCL14,IL-11,IL-29/IFNλ1,I-TAC/CXCL11,LIX/CXCL6/GCP-2,Lymphotactin/XCL1,M-CSF,MIG/CXCL9,MIP-3α/CCL20,MIP-3β/CCL19,NAP-2/CXCL7 |
| Human |
Cytokine/Chemokine |
LX-HCYP4MAG-64K-20 |
BAFF/Blys,BRAK/CXCL14,CCL28,CXCL16,HCC-4/CCL16,HMGB1,IFNβ,IL-14/α-Taxilin,IL-19,IL-24,IL-28B/IFNλ3,IL-32α,IL-34,IL-35, IL-36β/IL-1F8,IL-37/IL-1F7,IL-38/IL-1F10,MIP-4/PARC/CCL18,MPIF/CCL23,YKL40/CHI3L1 |
| Human |
T Cell |
LX-HSTCMAG-28SK-21 |
Fractalkine/CX3CL1,GM-CSF,IFNγ,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,IL-10,IL-12(p70),IL-13,IL-17A/CTLA8,IL-21,IL-23,I-TAC/CXCL11,MIP-1α/CCL3,MIP-1β/CCL4,MIP-3α/CCL20,TNFα |
| Human |
CD8+ T Cell |
LX-HCD8MAG-15K-17 |
sCD137/4-1BB/TNFRSF9,IL-4,IL-5,sFAS/TNFRSF6,sFasL,GM-CSF,Granzyme A ,GranzymeB,IFNγ,IL-2,IL-6,IL-10,IL-13,MIP-1α/CCL3, MIP-1β/CCL4,Perforin TNFα |
参考文献:
[1]Andreas Schlitzer , Wei Zhang , Mei Song , Xiaojing Ma. Recent advances in understanding dendritic cell development, classification, and phenotype. F1000Res. 2018 Sep 26;7:F1000 Faculty Rev-1558.
[2]Tim Worbs, Swantje I Hammerschmidt , Reinhold Förster. Dendritic cell migration in health and disease. Nat Rev Immunol. 2017 Jan;17(1):30-48.
[3]Laura Tiberio, Annalisa Del Prete, Tiziana Schioppa, Francesca Sozio, Daniela Bosisio, Silvano Sozzani. Chemokine and chemotactic signals in dendritic cell migration. Cell Mol Immunol. 2018 Apr; 15(4): 346–352.
[4]Matthew Collin, Venetia Bigley .Human dendritic cell subsets: an update. Immunology. 2018 May; 154(1): 3–20.
|


















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


