|
肥胖是健康的威胁,是现代社会中的全球性问题。在世界成年人口中,肥胖的人口数也逐年上涨。肥胖的增加与经济水平及医疗条件改善伴随的代谢性疾病如2型糖尿病、脂肪肝、心血管疾病的增加成正比。同时它也与一些非代谢性疾病如哮喘、阿尔茨海默病及某些癌症有关。在世界成年人口中,肥胖的人口数也逐年上涨。二型糖尿病(T2DM)在正常、超重和肥胖范围内的发病率线性上升非常高,当BMI超过35 kg/m2时,患糖尿病的相对风险要高40倍。

肥胖是指一定程度的明显超重与脂肪层过厚,是体内脂肪,尤其是甘油三酯积聚过多而导致的一种状态。由于食物摄入过多或机体代谢的改变而导致体内脂肪积聚过多造成体重过度增长并引起人体病理、生理改变或潜伏。
当人体进食热量多于消耗热量时,多余热量以脂肪形式储存于体内,其量超过正常生理需要量,且达一定值时遂演变为肥胖症,是一种慢性代谢性疾病。

肥胖症与多种合并症例如:糖尿病,高血压,心血管疾病,肾、肝并发症,支气管哮喘和阿尔茨海默症等疾病相关

肥胖症的特征是脂肪含量增加并且在脂肪组织中储能增加。脂肪量的增加可以通过增加脂肪细胞的大小(脂肪细胞肥大)或增加脂肪细胞的数量(脂肪细胞增多)来实现。此外,肥胖与炎症和胰岛素抵抗密切相关。
2型糖尿病(T2DM)是糖尿病的主要类型,占糖尿病人口的近90%。T2DM除了高血糖外也存在胰岛素抵抗的特点。
以高血糖为特征的代谢性疾病。高血糖则是由于胰岛素分泌缺陷或其生物作用受损,或两者兼有引起。长期存在的高血糖,导致各种组织,特别是眼、肾、心脏、血管、神经的慢性损害、功能障碍。
根据2019年国际糖尿病联合会(IDF)的报告,大约4.63亿成年人(20-79岁)患有糖尿病。
细胞因子(cytokines)
胰岛素抵抗和肥胖是大多数代谢综合征和心血管并发症的核心。这些代谢性疾病通常还引起炎症状态的改变,导致活性氧(ROS)产生增加[1]。
TNF-α、IL-1β和IFNγ均干扰脂肪细胞中的胰岛素受体信号转导[2,3]。相反,IL-10(多种抗炎免疫细胞群分泌)可能通过直接抑制炎症细胞因子的合成促进脂肪细胞中的胰岛素信号转导[4]。
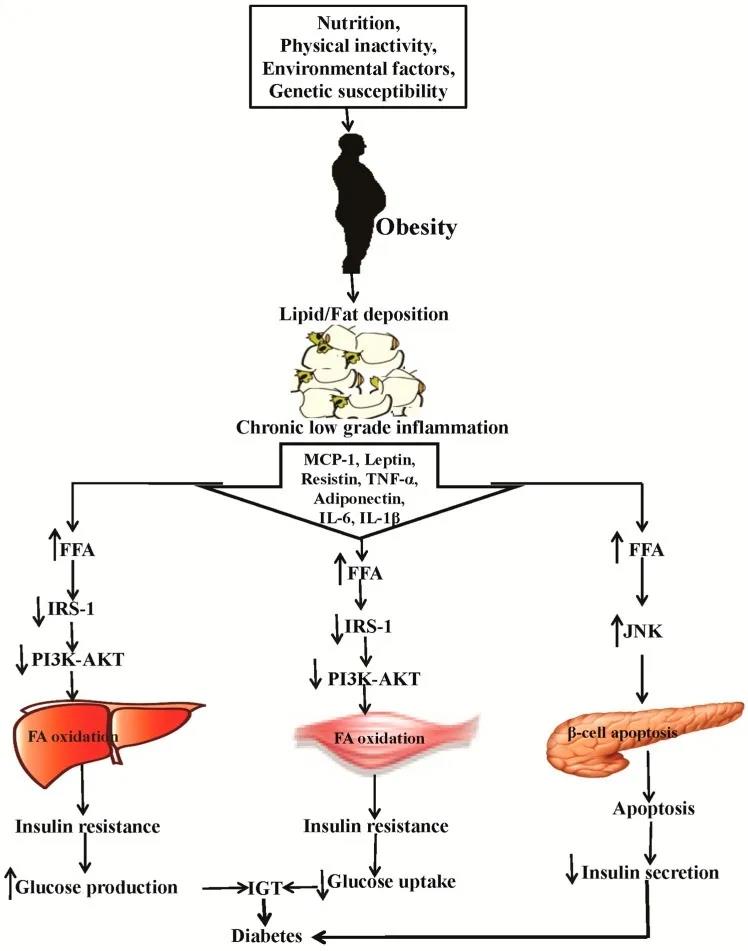
上图所示[5]:肥胖和糖尿病之间联系的示意图以及它们在骨骼肌、肝脏和胰腺中刺激不同炎症细胞因子、代谢酶和信号通路的作用。营养、缺乏运动、环境因素和遗传易感性导致肥胖和脂肪沉积,引发慢性低炎症,释放MCP-1、瘦素、抵抗素、TNF-α、IL-6和IL-1β。慢性炎症导致肝脏、骨骼肌和胰腺中FFA的分泌增加。FFA升高会降低肝脏和骨骼肌IRS-1和PI3K-AKT的表达,增加胰腺JNK的表达,最终导致肝脏和肌肉的胰岛素抵抗,增加胰腺的凋亡。胰岛素抵抗导致葡萄糖生产增加和葡萄糖摄取减少,胰岛细胞凋亡增加,胰岛素分泌减少。
瘦素(leptin)
脂肪细胞来源的脂肪因子瘦素发挥多效性作用,对调节能量平衡和细胞代谢、控制炎症和免疫反应以及维持心血管系统的稳态至关重要。肥胖或2型糖尿病(T2DM)患者的瘦素抵抗认为是组织对瘦素反应的减少。
瘦素的分泌,与脂肪和胰岛素呈正相关, 肥胖症中瘦素和胰岛素水平升高。
瘦素抵抗或瘦素信号传导不足会导致心脏功能障碍和心力衰竭的风险增加,这是肥胖和与T2DM相关的发病率和死亡率的主要原因[6]。
脂联素(Adiponectin)
脂联素和瘦素是脂肪细胞分泌最丰富的脂肪因子。脂联素是一种244氨基酸多肽,仅由脂肪组织表达和分泌,在血液中浓度很高(5-10磅/毫升)[7]。
脂联素可以通过肌组织胰岛素受体酪氨酸磷酸化,直接提高胰岛素敏感性,降低胰岛素抵抗[8],导致胰岛素/IGF-1信号的下调。
其次,脂联素也被称为抗炎细胞因子,因此它可以抑制炎性细胞因子的表达,如肿瘤坏死因子-α和IL-6,激活和抑制NF -κB[9],这可能是在这些慢性疾病相关的分子机制。并且脂联素通过激活PPAR-γ直接抑制血管生成,并通过激活caspase级联反应促进体内凋亡[10]。
胰岛素(insulin)
胰岛素通过典型的胰岛素信号级联调节碳水化合物、脂质和蛋白质的代谢,包括胰岛素受体(IR)、胰岛素受体底物(IRS)蛋白、PI3K和AKT[11,12]。胰岛素抵抗是指引起2型糖尿病(T2DM)的基本机制。当胰岛素分泌不能再补偿胰岛素抵抗时,就会发生T2DM。
胰高血糖素样肽(GLPs)
胰高血糖素样肽(GLPs)在摄入的营养物质后从肠内分泌细胞(L细胞)释放出来,包括GLP-1和GLP-2[13]。GLP-1通过刺激胰腺的胰岛ß细胞分泌胰岛素,抑制胃排空和减少食物摄入,在降低血糖和控制体重方面起着至关重要的作用。GLP-2具有恢复肠道稳态和诱导上皮增生的能力。
抑胃肽(GIP)
抑胃肽是由43个氨基酸组成的直链肽,属于胰泌素和胰高血糖素族,由小肠粘膜的K细胞所产生。
GIP与GLP-1类似,在进食后通过增加胰岛素分泌来调节餐后血糖。之前报道发现,糖尿病患者对GIP[59]的胰岛素反应减弱。此外,在动物模型中,GIP可以增加GLP-1的水平,增加GLP-1的[14]和DPP-4抑制剂也会增加GIP[15]。总之,这些数据认为GLP-1和GIP之间存在一个反馈回路[14,16]。
C肽(C-peptide)
C肽反映了胰腺β细胞分泌的胰岛素的情况,分泌的胰岛素量反映了人体的代谢需求。
瑞典进行的一项研究报告显示,诊断时的随机c肽水平可能有助于对DM型进行分类[17]。在T1DM中监测疾病进程也很有用。在儿童期发病的T1DM中,大多数患者在诊断后的2-3年内严重缺乏c肽,而在T2DM和青少年发病的成年型糖尿病(MODY)中,c肽水平持续[18]。c肽可在血液(空腹或非空腹)和尿液中检测到,且血c肽水平与尿c肽水平存在显著相关性[19]。
胰岛素样生长因子-1(IGF-1)
IGF-1是一种70个氨基酸的合成代谢激素,具有多种内分泌,旁分泌和自分泌作用。胰岛素和IGF-1均根据可用能量和基本底物(例如氨基酸)刺激合成代谢过程。胰岛素和IGF-1产生的合成代谢信号可通过抑制细胞凋亡。
IGF-1的作用是通过其与假定受体IGF-1R(酪氨酸激酶)的结合而介导的。IGF-1缺乏与胰岛素抵抗,脂质代谢受损,氧化损伤和神经激素轴失调有关[20-22]。
高水平的胰岛素还可以增强IGF-1的合成,并下调肝脏中的IGF-1结合蛋白,从而导致游离或活性IGF-1的生物利用度增加,通过与受体(IGF-R)结合的下游信号。
研究方法:
常用的研究方法包括:气相色谱-质谱联用技术(GC-MS),液相色谱-质谱联用技术(LC-MS),膜片钳技术,多因子检测技术等等。
我们拥有非常受欢迎的多因子检测技术(包括luminex、MSD等),所需样本量少,检测指标丰富。想进行代谢因子相关研究吗?指标的选择很重要,选择Labex,给你更多的panel,总有你想做的指标,快来pick我们吧!
| 种属 |
检测技术 |
货号 |
因子数 |
检测因子 |
| Human |
Luminex |
LX-171A7001M |
10 |
C-peptide,ghrelin,GIP,GLP-1,glucagon,insulin,leptin, |
| PAI-1 (total),resistin,visfatin |
| Human |
Luminex |
LX-HADK1MAG-61K |
5 |
Adiponectin, Adipsin, Lipocalin-2/NGAL, PAI-1 (Total), Resistin |
| Human |
Luminex |
LX-HADK2MAG-61K |
8 |
IL-1β, IL-6, IL-8, Insulin, Leptin, MCP-1, NGF, TNF-α |
| Human |
Luminex |
LX-HMHEMAG-34K |
15 |
Amylin (Active), Amylin (Total), C-Peptide, Ghrelin (Active), |
| GIP, GLP-1 (Active), GLP-1 (Total), Glucagon, IL-6, |
| Insulin, Leptin, MCP-1, PP, PYY, TNF-α |
| Mouse |
Luminex |
LX-171F7001M |
8 |
ghrelin,GIP,GLP-1,glucagon,insulin,leptin,PAI-1,resistin |
| Rat |
MSD |
LX-K15334D-1 |
3 |
GIP (active), GLP-1 (active), Glucagon |
| Human |
MSD |
LX-K15151C-1 |
3 |
IR, IGF-1R, IRS-1 |
| Human |
MSD |
LX-K15174C-1 |
3 |
GLP-1 (active), Glucagon, Insulin, Leptin |
| Mouse, Rat |
MSD |
LX-K15171C-1 |
3 |
GLP-1 (total), Glucagon, Insulin |
| Human |
MSD |
LX-K15275K-1 |
7 |
C-Peptide,GIP (total),GLP-1 (active), |
| Glucagon,Insulin,Leptin,PYY (total) |
| Human |
MSD |
LX-K15281K-1 |
22 |
BAFF, BDNF, β-NGF, C-Peptide, FGF-21, FGF-23, FSH, |
| Ghrelin (active), Ghrelin (total), GIP (active), GIP (inactive), |
| GIP (total), GLP-1 (active), GLP-1 (inactive), GLP-1 (total), Glucagon, Insulin, Leptin, Luteinizing Hormone (LH), PP, Proinsulin, PYY (total) |
| Human |
MSD |
LX-K151ACL |
87 |
BAFF, BDNF, β-NGF, C-Peptide, CTACK, ENA-78, Eotaxin, Eotaxin-2, Eotaxin-3, EPO, FGF-21, FGF-23, FLT3L, Fractalkine, FSH, G-CSF, Ghrelin (active), Ghrelin (total), GIP (active), GIP (inactive), GIP (total), GLP-1 (active), GLP-1 (inactive), GLP-1 (total), Glucagon, GM-CSF, GRO-α, I-309, IFN-α2a, IFN-β, IFN-γ, IL-1α, IL-1β, IL-1RA, IL-2, IL-2Rα, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12/IL-23p40, IL-12p70, IL-13, IL-15, IL-16, IL-17A, IL-17A/F, IL-17C, IL-17D, IL-17E/IL-25, IL-17F, IL-18, IL-21, IL-22, IL-23, IL-27, IL-29/IFN-λ1, IL-31, IL-33, Insulin, IP-10, Leptin, Luteinizing Hormone (LH), MCP-1, MCP-2, MCP-4, M-CSF, MDC, MIF, MIP-1α, MIP-5, PP, Proinsulin, PYY (total), SDF-1α, TARC, TNF-α, TNF-β, TPO, TRAIL, TSLP, VEGF-A, YKL-40 |
参考文献:
[1]Forrester S. J., Kikuchi D. S., Hernandes M. S., Xu Q., Griendling K. K. Reactive oxygen species in metabolic and inflammatory signaling. Circulation Research. 2018;122(6):877–902.
[2]Uysal KT, Wiesbrock SM, Marino MW, Hotamisligil GS. Protection from obesity-induced insulin resistance in mice lacking TNF-alpha function. Nature. 1997;389(6651):610–614.
[3]Xu H, Hirosumi J, Uysal KT, Guler AD, Hotamisligil GS. Exclusive action of transmembrane TNF alpha in adipose tissue leads to reduced adipose mass and local but not systemic insulin resistance. Endocrinology. 2002;143(4):1502–1511.
[4]Feuerer M, Herrero L, Cipolletta D, Naaz A, Wong J, Nayer A, et al. Lean, but not obese, fat is enriched for a unique population of regulatory T cells that affect metabolic parameters. Nat Med. 2009;15(8):930–939.
[5]Mohammed Kawser Hossain, Ahmed Abdal Dayem, Jihae Han, Yingfu Yin, Kyeongseok Kim, Subbroto Kumar Saha, Gwang-Mo Yang, Hye Yeon Choi, and Ssang-Goo Cho. Molecular Mechanisms of the Anti-Obesity and Anti-Diabetic Properties of Flavonoids. Int J Mol Sci. 2016 Apr; 17(4): 569.
[6]Mareike S. Poetsch, Anna Strano, and Kaomei Guan. Role of Leptin in Cardiovascular Diseases. Front Endocrinol (Lausanne). 2020; 11: 354
[7]Obesity related hyperinsulinaemia and hyperglycaemia and cancer development. Arch Physiol Biochem. 2009;115:86–96.
[8]Plasma adiponectin concentration is associated with skeletal muscle insulin receptor tyrosine phosphorylation, and low plasma concentration precedes a decrease in whole-body insulin sensitivity in humans. Diabetes. 2002;51:1884–1888.
[9]Adiponectin as an anti-inflammatory factor. Clin Chim Acta. 2007;380:24–30.
[10]Adiponectin-induced antiangiogenesis and antitumor activity involve caspase-mediated endothelial cell apoptosis. Proc Natl Acad Sci U S A. 2004;101:2476–2481.
[11]Biochemical and cellular properties of insulin receptor signalling. Nat. Rev. Mol. Cell Biol 19, 31–44 (2018).
[12] Critical nodes in signalling pathways: insights into insulin action. Nat. Rev. Mol. Cell Biol 7, 85–96 (2006).
[13] The pivotal relation between glucagon-like peptides, NFκB and inflammatory bowel disease. Clin Exp Pharmacol Physiol. 2020 Jun 8.
[14]What do we know about the secretion and degradation of incretin hormones? Regul Pept. 2005;128(2):117–24.
[15]The dipeptidyl peptidase 4 inhibitor vildagliptin does not accentuate glibenclamide-induced hypoglycemia but reduces glucose-induced glucagon-like peptide 1 and gastric inhibitory polypeptide secretion. J Clin Endocrinol Metab. 2007;92(11):4165–71.
[16] Physiology of incretins in health and disease. Rev Diabet Stud. 2011;8(3):293–306. [17]C-peptide in the classification of diabetes in children and adolescents. Pediatr Diabetes. 2012;13:45–50. [18]Altered insulin secretory responses to glucose in subjects with a mutation in the MODY1 gene on chromosome 20. Diabetes. 1995;44:699–704.
[19]Determination of C-peptide in children: when is it useful? Pediatr Endocrinol Rev. 2013;10:494–502.
[20]Hepatoprotective effects of insulin-like growth factor I in rats with carbon tetrachloride-induced cirrhosis. Gastroenterology. 1997;113(5):1682–1691.
[21]Low doses of insulin-like growth factor I improve insulin resistance, lipid metabolism, and oxidative damage in aging rats. Endocrinology. 2008;149(5):2433–2442.
[22]Protective effects of IGF-1 on cortical nerve cells of neonatal rats under oxidative stress] Zhongguo Dang Dai Er Ke Za Zhi. 2014;16(2):203–207.
|











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


