|
小编上周分享的文献小伙伴们有认真在看吗?看不到结论的感觉是不是很难受,那我们就继续我们的阅读之旅吧!
上周的文章通过体内体外实验验证了CD8 T细胞以及巨噬细胞对肿瘤细胞的影响。作者先前对人的肺和卵巢肿瘤进行的研究发现,ECM的结构控制着肿瘤内的T细胞迁移及其与恶性细胞的接触能力,疏松的纤连蛋白和胶原蛋白区域促进T细胞迁移,而致密基质区具有相反的作用。因此,在缺乏巨噬细胞的情况下,T细胞更活跃地迁移的一种可能机制可能是ECM降低。所以作者对纤连蛋白在未用PLX3397处理的小鼠中Met-1肿瘤的分布进行了评估。
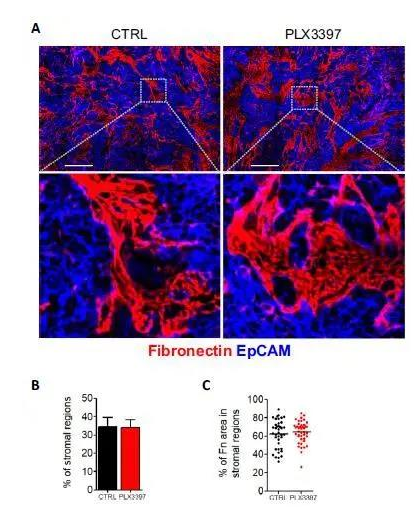
补充图6:TAM的消耗对基质中纤维连接蛋白的数量和密度没有影响。
(A)共焦图像。(B)显示对照组和PLX3397治疗小鼠肿瘤中纤维连接蛋白表面的柱状图。(C)基质区纤维连接蛋白的密度,以100- 100- mal m区纤维连接蛋白的百分比表示。n = 6只小鼠/组,来自两个独立实验。
PLX3397在荷瘤小鼠中的巨噬细胞消耗不会影响细胞外基质的结构。
为了测试巨噬细胞消耗对ECM结构的影响,作者进行了免疫染色实验,以评估纤连蛋白在未用PLX3397治疗的小鼠中的Met-1肿瘤中的分布(图S6)。在Met-1肿瘤中,富含纤连蛋白的基质区占切片总表面的30%,在对照和PLX3397条件之间未观察到差异(图S6 B)。然后,作者分析了两种情况下基质中纤连蛋白纤维的密度,也没有发现任何差异(图S6 C)。因此,在这些肿瘤模型中,用PLX3397清除TAM不会改变ECM的结构。这些结果表明,PLX3397处理后观察到的CD8 T细胞数量增加和迁移不是由于ECM的松动引起的。
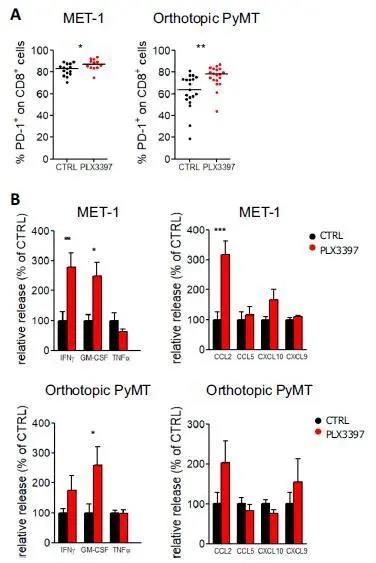
补充图7:TAM缺失改变了肿瘤的微环境。
(A)通过流式细胞术分析使用PLX3397处理和未处理组的Met-1模型和原位PyMT肿瘤中表达PD-1的CD8 T细胞比例。n=15只(Met-1)和18只(PyMT)小鼠/组,来自3-4个独立实验。*P < 0.05, **P < 0.01。(B)新鲜Met-1肿瘤切片保存18 h后产生的细胞因子和趋化因子的Luminex分析; n=10只小鼠/组,来自3个独立实验; *P < 0.05, **P < 0.01, ***P < 0.001。
PLX3397与检查点抑制剂抗PD-1的组合可进一步增加肿瘤部位的CD8 T细胞募集并减少肿瘤负担。
即使巨噬细胞消耗后,肿瘤部位的CD8 T细胞数量增加,且肿瘤巢内的淋巴细胞浸润性更好,但这并没有对肿瘤生长产生重大影响。但是,作者注意到,肿瘤内CD8 T细胞显示出PD-1的高表达,并且在使用PLX3397后,该表达进一步增加(图S7 A)。此外,在PLX3397处理的肿瘤中观察到全肿瘤切片上清液中IFN-γ,GM-CSF和CCL2的释放增加,这表明巨噬细胞数量的减少可以改变肿瘤的微环境,促进CD8 T细胞募集(可能通过减少对单核细胞和T细胞使用的趋化因子CCL2的竞争)并支持抑制性较小的环境(图S7 B)。
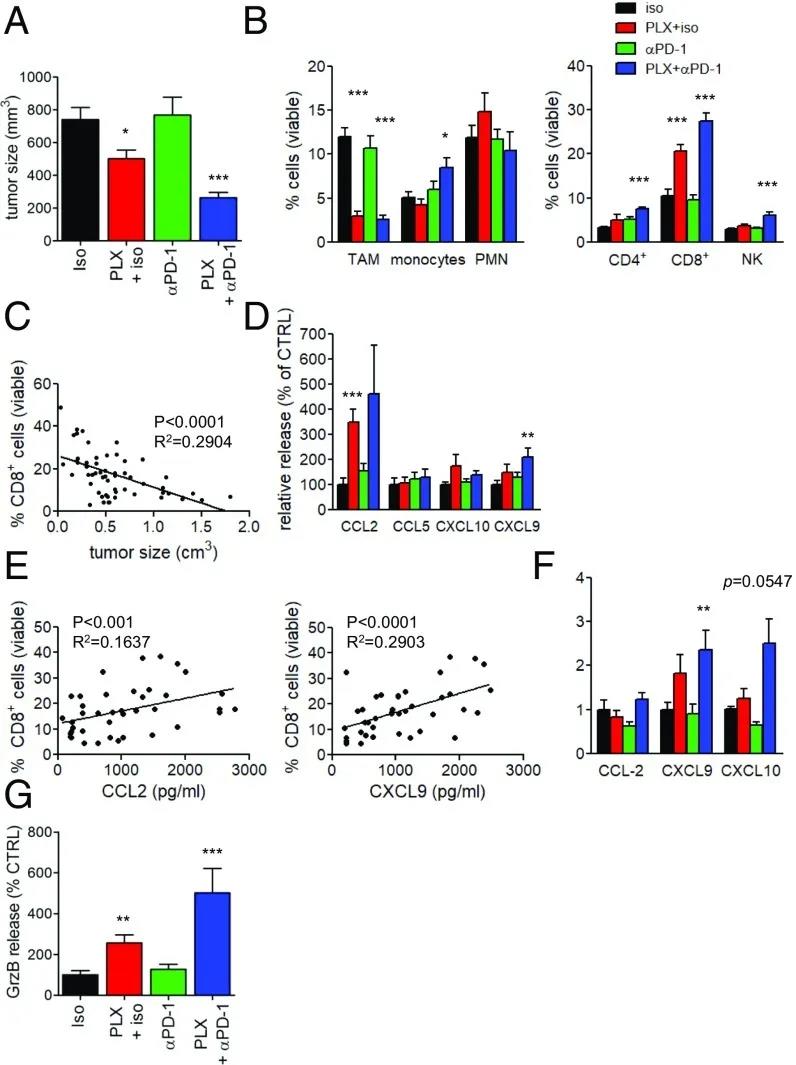
图4:TAM缺失增强荷瘤小鼠抗PD-1免疫治疗效果。
(A)各治疗组的肿瘤体积。n = 21只小鼠/组,来自3个独立实验。 *P < 0.05 and ***P < 0.001。(B)流式细胞术测定肿瘤总活细胞中骨髓细胞群(左)和淋巴细胞群(右)的频率。n = 15只/组,来自3个独立实验; *P < 0.05 and ***P < 0.001。(C) CD8 T细胞在总活细胞中所占比例与肿瘤体积的关系; n = 60。(D)新鲜Met-1肿瘤切片培养18 h后产生的炎性趋化因子的Luminex分析; n = 10只小鼠/组,来自3个独立实验。**P < 0.01 and ***P < 0.001。(E)培养18 h Met-1肿瘤切片产生的CCL2(左)和CXCL9(右)对总活细胞中CD8 T细胞比例的影响。(F)通过qRT-PCR检测肿瘤中Met-1细胞趋化因子mRNA水平。 **P < 0.01。(G) ELISA检测新鲜Met-1肿瘤切片培养18 h后上清颗粒酶B释放量; n = 10只小鼠/组,来自3个独立实验; **P < 0.01, ***P < 0.001。
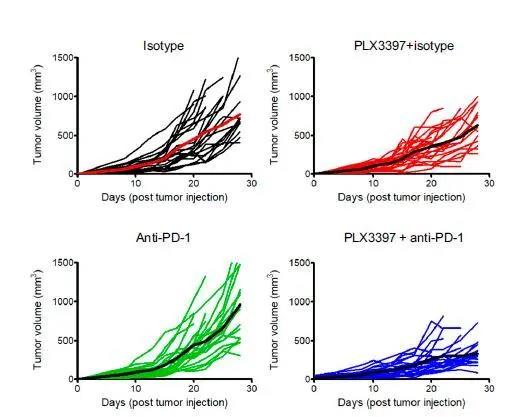
补充图8:CSF-1R抑制剂与抗PD-1联合治疗可降低肿瘤生长。
图为四个不同治疗组小鼠个体的肿瘤生长曲线。
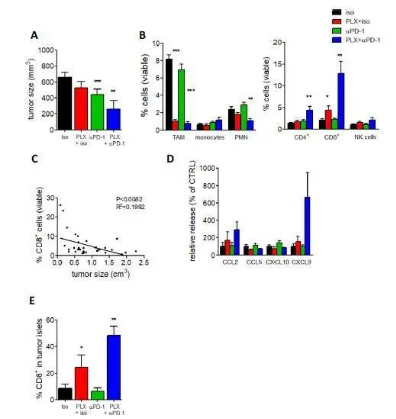
补充图9:TAM缺失增强了PyMT荷瘤小鼠的抗PD-1免疫治疗。
(A)各治疗组小鼠的肿瘤体积。n = 10只小鼠/组,来自两个独立实验。(B)流式细胞术测定肿瘤总活细胞中骨髓亚群(左)和淋巴亚群(右)的频率。n = 10只小鼠/组,来自两个独立实验。 *P < 0.05, **P < 0.01, ***P < 0.001。(C) CD8 T细胞在总活细胞中所占比例与肿瘤体积的关系; n = 40。(D)新鲜的PyMT肿瘤切片保存18小时后产生的炎性趋化因子的Luminex分析; n = 6只小鼠/组。(E)四种情况下肿瘤胰岛中CD8 T细胞比例。n = 10只/组; *P < 0.05, **P < 0.01。
PLX3397对T细胞迁移和定位以及CD8肿瘤浸润淋巴细胞(TILs)表型的影响促使作者将这种消耗策略与抗PD-1 (一种免疫检查点抑制剂)结合使用治疗包括肺癌在内的实体瘤。FVB移植小鼠从肿瘤注射后7 d直至死亡,接受PLX3397或对照食物处理,PLX3397治疗后每4 天腹腔注射抗PD-1或同种型对照抗体。尽管单独的抗PD-1抗体能够降低原位肿瘤的生长,但不能降低Met-1的肿瘤生长,但PLX3397与检查点抑制剂的组合均具有强效作用(图4A、S8和S9A)。当作者分析这些肿瘤的细胞浸润时,通过流式细胞术实验观察到单独使用抗PD-1不会对微环境的免疫组成产生任何影响(图4B和图S9B)。相反,与单独使用PLX3397相比,联合治疗进一步扩大了PyMT模型中CD8 T细胞的百分比;此外,它也增加了CD4 T细胞以及在Met-1模型中的NK细胞的百分比(图4 B和图S9 B,右)。在所有的实验中,CD8 T细胞的数量与肿瘤大小成反比,突显了该参数在肿瘤生长控制和抗PD-1治疗反应中的重要性(图4 C和图S9 C)。
当作者分析源自这些实验的肿瘤切片的上清液时,作者注意到与单独使用任一方法相比联合治疗导致了一个趋化因子环境,它可以进一步加强T细胞浸润(图4 D和图S9 d)。通过Luminex实验,作者发现CCL2和CXCL9与存在于肿瘤部位的CD8 T细胞的百分比直接相关,这表明这些趋化因子在募集效应细胞中起着至关重要的作用(图4 E),而CCL5似乎与这些肿瘤模型无关(图4 D)。此外,在PLX3397和抗PD1结合后,CXCL9和CXCL10(CXCR3的主要配体)在分离的肿瘤细胞中被上调(图4 F),表明该治疗可诱导趋化因子的表达,促进淋巴细胞向肿瘤胰岛的浸润。与观察到的肿瘤部位效应细胞的增加和肿瘤大小的减少相一致,联合治疗显着增强了肿瘤切片中颗粒酶B的分泌(图4 G)。
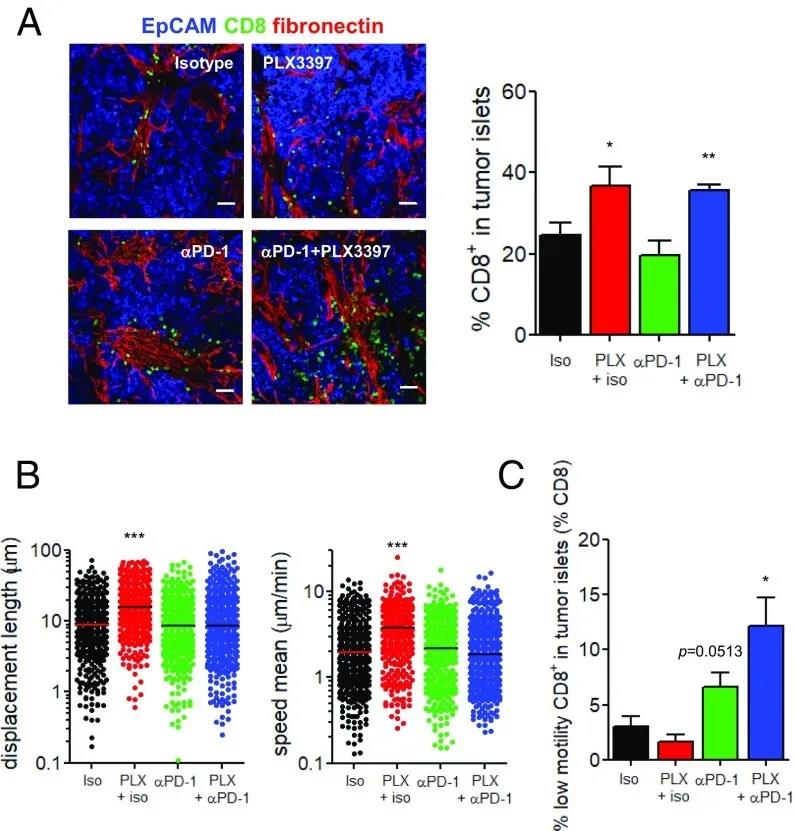
图5:CSF-1R抑制剂和抗PD-1联合治疗影响肿瘤胰岛CD8 T细胞数量和运动。
(A)每种情况下Met-1肿瘤中CD8 T细胞的分布情况。(A,左)EpCAM(蓝色)、CD8 T细胞(绿色)和纤连蛋白(红色)染色的Met-1肿瘤切片共聚焦图像。(A,右)Met-1肿瘤胰岛中常驻CD8 T细胞的比例; n = 10只小鼠/组,来自3个独立实验; *P < 0.05 and **P < 0.01。(B) Met- 1肿瘤切片间质和肿瘤胰岛内内源性CD8 T细胞的位移长度(左)和平均速度(右); n = 7只小鼠/组,来自3个独立实验,每只小鼠2-3次失效。***P < 0.001(C)肿瘤胰岛中CD8 T细胞的比例(平均速度:<2 m/min); n = 7只小鼠/组,来自3个独立实验,2-3次失效/小鼠; *P < 0.05。
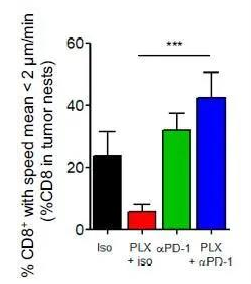
补充图10:抗PD-1治疗可增加与肿瘤细胞长期接触的CD8 T细胞的比例。
图为在20分钟内,平均速度<2 μm/min的肿瘤巢CD8 T细胞百分比。***P < 0.001。
PLX3397和抗PD-1的组合导致大量CD8 T细胞与肿瘤细胞长时间联系。
然后,作者通过共聚焦显微镜分析了这些治疗后肿瘤切片上CD8 T细胞的定位和活性。单独使用抗PD-1不会改变CD8 T细胞的浓度和肿瘤基质分布,这表明PD-1 / PD-L1相互作用可能对巨噬细胞介导的淋巴细胞滞留不是至关重要的(图5A和图S9 E)。相比之下,联合疗法显着增加了肿瘤胰岛中CD8 T细胞的比例,甚至比PLX3397情况下的比例更高(图5A和图S9E)。对肿瘤胰岛中CD8 T细胞运动性的分析证实,PLX3397处理小鼠肿瘤中的CD8 T细胞活跃迁移,其位移长度和平均速度证实了这一点(图5B)。有趣的是,联合疗法导致CD8 T细胞的低运动性,表明抗PD-1可以改变巨噬细胞不存在时细胞毒性淋巴细胞与肿瘤细胞之间的接触持续时间(图5B)。因此,与PLX3397相比,在联合治疗中,肿瘤岛中CD8 T细胞阻滞的频率增加了(定义为在20分钟记录期间平均速度小于2 µm / min的细胞)(图S10)。当作者将浸润肿瘤巢的CD8 T细胞比例和停滞的淋巴细胞比例结合在一起时,作者发现与其他条件相比,PLX3397+抗PD-1治疗导致肿瘤胰岛中低活性CD8 T细胞比例增加(图5C)。
通过巨噬细胞耗竭消耗而实现的基质中CD8 T细胞的释放可以使淋巴细胞更好地浸润到肿瘤巢中并扫描肿瘤细胞。在这些条件下,PD-1阻滞促进T细胞减速,可能与肿瘤细胞形成有效接触导致其破坏。
这篇文章的分享打这里就结束了,文章的工作量还是很大的,并且免疫荧光、流式细胞术、Luminex都是最近比较流行的技术。所以文章的档次也比较的高。那这么高大上的技术不用在自己的文章中岂不是可惜。
文中的实验技术你也可以拥有!!!
1.样本提取: 我们有美天旎组织处理器,可制备单细胞悬液和组织或细胞匀浆。

2. 多因子检测:luminex平台热销pannel,筛选验证同步进行,省时省力
| 种属 |
检测技术 |
检测方向 |
货号 |
检测因子 |
| Human |
Luminex |
Cytokine |
LX-12007283 |
FGF-basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-1α, IL-2Rα, IL-3, IL-12(p40), IL-16, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, GRO-α, HGF, IFN-α2, LIF, MCP-3, IL-10, IL-12(p70), IL-13, IL-15, IL-17, IP-10, MCP-1(MCAF), MIG, β-NGF, SCF, SCGF-β, SDF-1α, MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF, CTACK, MIF, TRAIL, IL-18, M-CSF, TNF-β |
| Mouse |
Luminex |
Cytokine |
LX-M60009RDPD |
IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12 (p40), IL-12 (p70), IL-13, IL-17A, Eotaxin, G-CSF, GM-CSF, IFN-γ, KC, MCP-1 (MCAF), MIP-1α, MIP-1β, RANTES, TNF-α |
3. 流式染色:现可进行流式BD celesta 12色染色,细胞培养加染色一条龙。

4. 免疫组化:包括DAB染色、HE染色、Masson染色、免疫荧光(IF)
|


















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


