|
小编最近在读文献,想和大家分享一下读文献的心得,看看我们和高分的文献究竟差多少。我们怎样才能get高分文献呢?快来学习一下吧。

小编这次选取的文章是来自PNAS杂志,影响因子为9+,还是比较有质量的。文章是关于肿瘤免疫治疗的研究,题目为:巨噬细胞阻碍CD8 T细胞到达肿瘤细胞,限制抗PD-1治疗的效果。
背景介绍
CD8 T细胞是对抗癌症的关键角色。为了杀死肿瘤细胞,T细胞需要完成几个功能。它们应该在肿瘤中积累,然后有效地迁移,与恶性细胞进行物理接触,之后对肿瘤抗原和其他细胞的激活信号做出充分反应。尽管一些患者表现出完全而持久的肿瘤消退,但是在大多数个体中,这些治疗无效。识别阻止T细胞杀死肿瘤细胞的其他障碍是实现更有效治疗的主要挑战。
有缺陷的T细胞向肿瘤内的迁移构成了对肿瘤免疫治疗的抵抗机制。癌由两个定义的不同区域组成,即肿瘤岛和周围的基质,富含细胞外基质(ECM)蛋白,成纤维细胞,血管和免疫细胞。一旦T细胞从血液进入肿瘤基质,它们必须在这种复杂的环境中才能到达肿瘤细胞。
肿瘤是异常ECM失调的组织。在小鼠自发性乳腺肿瘤模型中,已发现肿瘤相关巨噬细胞(TAMs)和CD11b +树突状细胞(DCs)数量超过CD103 + DC,被认为是肿瘤中最有效的T细胞刺激性抗原呈递细胞(APC)。根据该模型,通过与无效的APC结合,可以防止CD8 T细胞与免疫刺激性CD103 + DC接触。尚不清楚在人类肿瘤中是否也发生相同的过程。此外,这种CD8 T细胞–TAM相互作用对肿瘤生长的功能后果仍然不清楚。
在这里,作者分析了TAM在鼠类和人类癌中CD8 T细胞分布和迁移控制中的作用。通过使用动态成像显微镜,作者发现内源性CD8 T细胞与肿瘤基质中的TAMs形成了长期相互作用。在小鼠肿瘤模型中,作者使用PLX3397(Pexidartinib),CSF-1R,c-kit和Flt3的酪氨酸激酶的临床测试抑制剂以及特定CSF-1R抑制剂PLX5622来消耗的TAMs。这种治疗显着增加了肿瘤浸润性CD8 T细胞的数量、迁移以及肿瘤细胞接触的能力。并且作者通过流式分析技术和luminex技术分别检测了不同标记的T细胞(如CD4、CD11b、CD45等)和细胞、趋化因子(包括IFN-γ、GM-CSF、TNF-α、CCL2、CCL5、CXCL10、CXCL9)。这种巨噬细胞消耗策略改善了抗PD-1癌症的免疫疗法,突显了治疗调节巨噬细胞作为检查点抑制剂辅助治疗的重要性。
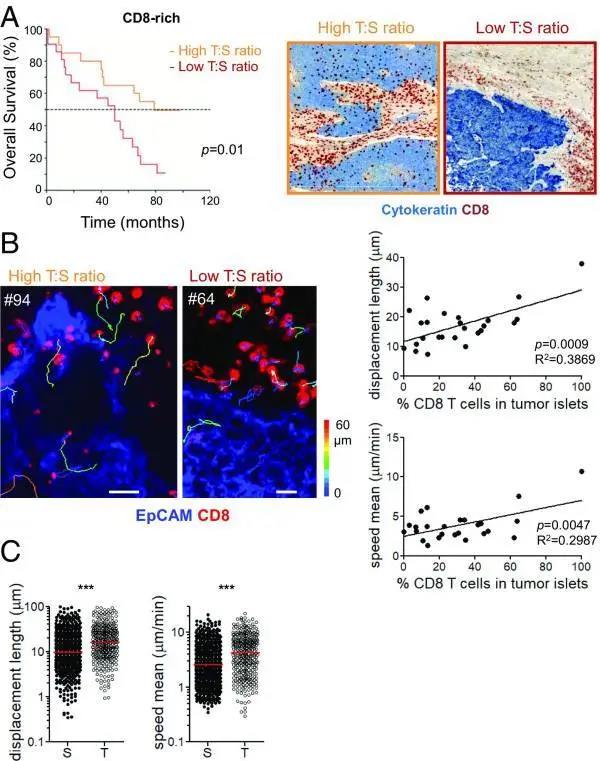
图1:CD8 T细胞浸润进入肿瘤胰岛在肺鳞癌中具有良好的预后价值,并且与淋巴细胞运动性有关
(A)根据胰岛中CD8 T细胞的密度,对I–II期鳞状细胞癌患者进行生存分析。使用CD8 T:S值0.16(中位数)作为确定高和低组的临界值。右侧表示细胞角蛋白(蓝色)和CD8 T细胞(红色)染色的人肺肿瘤的代表性图像。(B,左)在抗epcam(肿瘤细胞)染色的切片中,单个内源性CD8 T细胞(红色)的时间推移轨迹快照(蓝色)。(比例尺:20米);(B,右)内源性CD8 T细胞置换长度(上)和平均速度(下)与肿瘤胰岛中CD8 T细胞百分比的关系; n=9。(C)人鳞状细胞非小细胞肺癌肿瘤切片间质区和肿瘤细胞区常驻CD8 T细胞的位移长度(左)和平均速度(右);n = 9;中位数用红色表示。***P < 0.001。
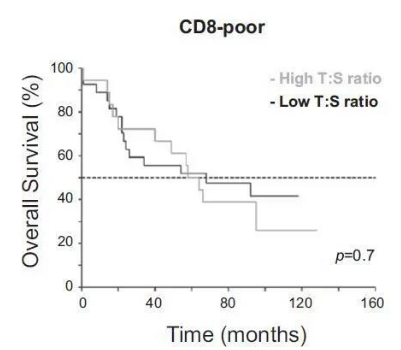
补充图1:低数量的CD8 T细胞与肺鳞状细胞癌的总生存率降低有关。
根据肿瘤胰岛CD8 T细胞密度分析ⅰ期肺鳞癌患者的生存分析根据CD8 T细胞的T:S值将瘤内CD8 T细胞数量较少的患者(n = 50)分为两组。用CD8 T:S值0.16来判断高分组和低分组。采用Kaplan Meier曲线估计两组的总生存,log-rank检验比较两组曲线的差异。
CD8 T细胞浸润到肿瘤岛是肺鳞状细胞癌的良好预后参数,并且与淋巴细胞运动性有关。
在一组肺鳞状细胞癌患者中,作者进行了石蜡包埋的组织切片,以了解CD8 T细胞相对于肿瘤胰岛(由细胞角蛋白染色)和周围基质的定位。在富含CD8 T细胞的肿瘤中(截止361个CD8细胞/ 平方毫米),表明T:S比率高(0.16-0.83)的患者的生存率显着优于比率低于0.15的患者(图1A,P = 0.01)。CD8细胞浸润肿瘤巢的能力的CD8肿瘤间质比(T:S)为一个独立的参数来区分患者的总体生存率。预后最好的患者是CD8 T细胞数量高且T:S比高的患者,因为CD8淋巴细胞数量少与总生存率降低相关,而与T:S率无关(图S1中CD8差的患者,P = 0.7)。
作者使用振动切片机厚切片的技术进一步分析新鲜肺鳞状细胞癌的3D环境中内源性CD8 T细胞的分布和实时运动。在图1B的左图中,显示两名代表性患者的肿瘤浸润CD8 T细胞在实时显微镜下的轨迹和定位。通过这种方法,作者能够观察到,对于每个微观视野,通过细胞的移位长度和平均速度来衡量的CD8 T细胞运动性与细胞浸润肿瘤巢的比例直接相关(图1B,右)。
作者已经观察到,在人类肺肿瘤中,相对于肿瘤巢,基质中富含CD8 T细胞,这种定位部分是由ECM纤维的密度和组织决定的,它可以改变基质中的淋巴细胞的能动性(10,11)。此外,与肿瘤岛相比,淋巴细胞迁移更慢,从而减少了基质中的位移。这种差异在肺鳞状细胞瘤中尤为明显(图1 C),这促使作者研究了间质室的其他特征是否会影响T细胞运动,并解释了在许多癌症患者中观察到的T细胞排斥情况。
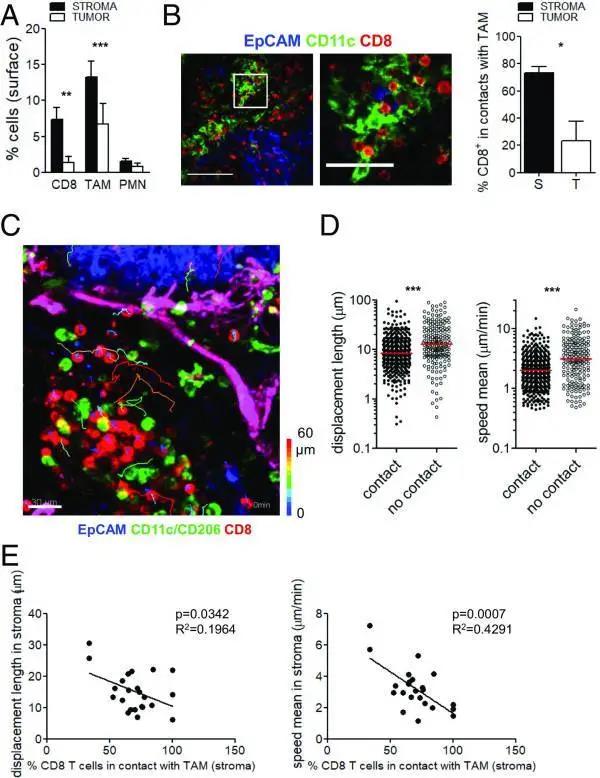
图2:在人类肺肿瘤中,CD8 T细胞与间质进行了长期的相互作用。
(A)CD8 T细胞、TAMs和多形核细胞(PMNs)在间质和肿瘤岛的分布; n = 8,** P <0.01和*** P <0.001。(B,左)EpCAM(蓝色)、CD11c(绿色)和CD8(红色)染色的人肺肿瘤切片共聚焦图像。(B,右)CD8 T细胞与TAMs接触的频率; n = 7,* P <0.05。(C)与TAMs和EpCAM肿瘤细胞相关的内源性CD8 T细胞的追踪。(标尺:30μm)
(D)记录20分钟内内源性CD8 T细胞与TAM接触或未接触时的位移长度(左)和平均速度(右); n = 9,*** P <0.001。(E)基质中内源性CD8 T细胞的位移长度(左)和平均速度(右)与各显微镜视野内同一区域接触TAMs的CD8 T细胞的百分比有关, n = 9。
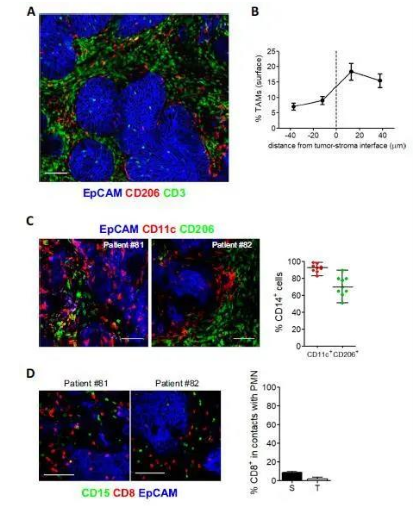
补充图2:TAMs和多形核细胞(PMNs)在人肺肿瘤中的分布。
(A)通过共聚焦实验分析TAMs和T细胞在肿瘤岛周围的间质中富集(标尺:50μm)(B)TAMs在肿瘤胰岛周围聚集。(C,左)抗体染色的人肺肿瘤切片共聚焦图像。(C,右)流式细胞术检测肺鳞状细胞癌中CD11c+和CD206+巨噬细胞百分比的直方图。(D,左)EpCAM(蓝色)、CD15(绿色)和CD8(红色)染色的两块人肺肿瘤切片共聚焦图像。(D,右)CD8 T细胞与间质和肿瘤胰岛中pmn接触的频率, n = 15个显微镜视野/ 3例患者。
CD8 T细胞与基质巨噬细胞长期保持接触,从而降低了它们在肿瘤微环境中的运动能力。
作者通过免疫荧光研究了肺鳞状细胞癌患者肿瘤活检中主要免疫细胞群的分布,并注意到,与T淋巴细胞相比,间质中也富含巨噬细胞(图2A和图S2A)。在这些肿瘤中,可被CD68和CD11c标记物染色的巨噬细胞通常在25 µm厚的EpCAM +肿瘤胰岛的基质边界内壁(图S2B)。值得注意的是,基质中大多数巨噬细胞表达CD206和CD163,而在一些样本中肿瘤巢中发现的巨噬细胞很少表达这些标志物(图S2C)。从图2B中可以观察到,巨噬细胞和CD8 T细胞在基质中的接触要比周围肿瘤细胞区域的多。有趣的是,与肿瘤岛相比,CD8 T细胞和中性粒细胞之间的接触更为罕见,在基质室中没有富集(图2A和图S2D)。
为了了解这些相互作用是否能够影响基质中的T细胞运动,作者通过荧光偶联Fab抗体追踪了鳞状细胞新鲜肿瘤切片中CD8 T细胞的轨迹,并观察肿瘤细胞(EpCAM +)和巨噬细胞(CD11c +,CD206 +或双阳性)。图2C中可以看出,巨噬细胞形成了一个相对静态的细胞网络,而CD8 T细胞则表现出不同的行为,一些细胞活跃地迁移,而另一些细胞则不那么活跃。进一步实验发现,被抑制的CD8 T细胞与TAMs接触。此外,基质中的大多数CD8- TAM接触持续时间较长(至少20分钟的记录时间),即使相互作用时间较短,CD8 T细胞的运动也会减慢。实际上,当作者测量CD8 T细胞位移长度和平均速度时,作者看到,与未接触巨噬细胞的CD8 T细胞相比,在这段时间内与巨噬细胞接触的淋巴细胞的运动性降低,这两个参数都显示了这一点(图2 d)。在这些样本中可以观察到与巨噬细胞接触的基质CD8 T细胞的百分比与这些淋巴细胞在基质中的平均速度之间的反比关系进一步证实了这一点(图2 E)。
因此,作者推测TAMs与其他基质元素(如ECM纤维和成纤维细胞)一起,可以降低基质中CD8 T细胞的能动性,从而有助于将CD8 T细胞限制在该区域并限制其进入肿瘤巢。
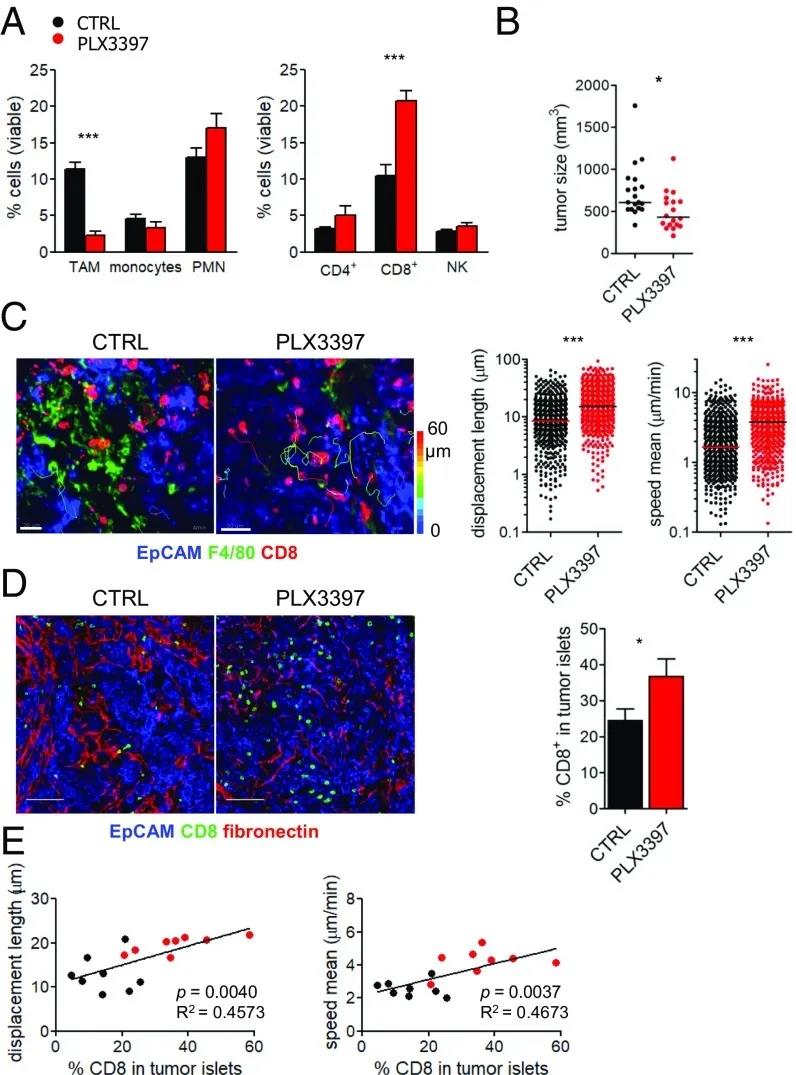
图3:TAM缺失增加了携带Met-1小鼠的CD8 T细胞数量、运动性和肿瘤胰岛的浸润。
(A)通过流式细胞术分析肿瘤活细胞总数中骨髓亚群(左)和淋巴亚群(右)的频率。结果显示为平均扫描电镜; *** P <0.001(B)在处死小鼠时确定的肿瘤体积,n= 22只小鼠/组,P <0.05。(C)来自用PLX3397处理或未处理的小鼠的Met-1肿瘤切片中的常驻CD8T细胞的运动性。(C,左)单个驻留CD8 T细胞(红色)相对于F4 / 80 + TAM(绿色)和EpCAM +的轨迹肿瘤细胞(蓝色),(标尺:25 µm)。(C,右)用PLX3397处理或未用PLX3397处理的小鼠的肿瘤切片中内源性CD8 T细胞的位移长度(左)和平均速度(右),n = 12只小鼠/组。(D)在control和PLX3397治疗的两组小鼠的肿瘤切片中常驻CD8T细胞的分布。(D,左)共焦图像(标尺:100 µm)。(D,右)在胰岛中CD8 T细胞的比例表示为平均值±SEM;n = 11;* P <0.05。(E)内源性CD8 T细胞的位移长度(左)和平均速度(右)与肿瘤胰岛中CD8 T细胞百分比的关系。
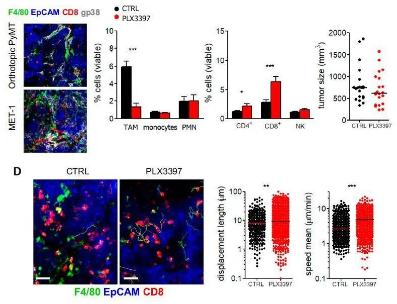
补充图3:在正位PyMT肿瘤中,TAM缺失可增加T细胞数量和运动性。
(A)用抗体染色的原位PyMT肿瘤(上)和Met-1肿瘤(下)的共聚焦图像。(B) PyMT肿瘤总活细胞中骨髓亚群(左)和淋巴亚群(右)的频率。n = 18只小鼠/组,来自4个独立实验; *P < 0.05 和 ***P < 0.001。
(C)小鼠肿瘤体积; n = 20只小鼠/组,来自4个独立实验。(D,左)常驻CD8 T细胞(红色)与F4/80+ TAMs(绿色)和EpCAM+肿瘤细胞(蓝色)的关系轨迹。(标尺:20μm)。(D,右)使用PLX3397或未使用PLX3397的小鼠肿瘤切片中内源性CD8 T细胞的位移长度(左)和平均速度(右),n = 10只/组,2 ~ 4次/只,3次独立实验;**P < 0.01 和 ***P < 0.001。
补充图4:在正位PyMT肿瘤中,TAM缺失可增加T细胞数量和运动性。
(A)用抗体染色的原位PyMT肿瘤(上)和Met-1肿瘤(下)的共聚焦图像。(B) PyMT肿瘤总活细胞中骨髓亚群(左)和淋巴亚群(右)的频率。n = 18只小鼠/组,来自4个独立实验; *P < 0.05 和 ***P < 0.001。
(C)小鼠肿瘤体积; n = 20只小鼠/组,来自4个独立实验。(D,左)常驻CD8 T细胞(红色)与F4/80+ TAMs(绿色)和EpCAM+肿瘤细胞(蓝色)的关系轨迹。(标尺:20μm)。(D,右)使用PLX3397或未使用PLX3397的小鼠肿瘤切片中内源性CD8 T细胞的位移长度(左)和平均速度(右),n = 10只/组,2 ~ 4次/只,3次独立实验;**P < 0.01 和 ***P < 0.001。
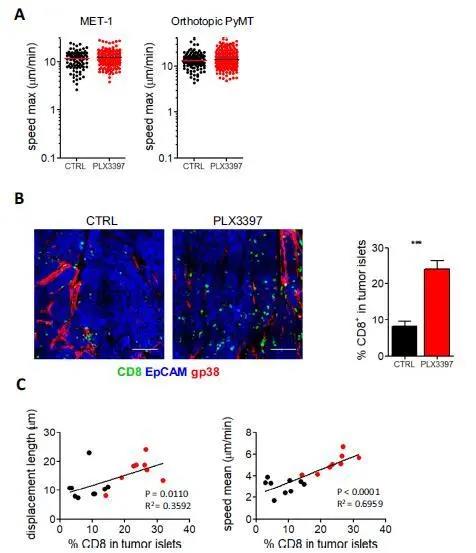
补充图5:TAM缺失与CD8 T细胞的运动行为。
(A)内源性CD8 T细胞在携带Met-1(左)或正位PyMT(右)肿瘤并使用PLX3397治疗或未治疗的小鼠肿瘤切片中自由迁移的最大速度。(B)共聚焦分析 PLX3397处理组和control组小鼠原位PyMT肿瘤切片中CD8 T细胞的分布, ***P < 0.001。(C)正位PyMT肿瘤切片内内源性CD8 T细胞的位移长度(左)和平均速度(右)与肿瘤胰岛中CD8 T细胞百分比的关系。
PLX3397在荷瘤小鼠中的巨噬细胞耗竭能够增加CD8 T细胞数量和运动性,从而增加对肿瘤巢的浸润。
为了验证巨噬细胞对T细胞运动的影响,作者在两种小鼠模型(MMTV-PyMT移植模型和Met-1模型)中进行了实验可以很容易地实现这些细胞的耗竭。与自发的MMTV-PyMT系统相比,这两种肿瘤模型的重现性和生长速度都比较方便;此外,与大多数上皮-间充质转变的细胞系相比,它们对于研究免疫细胞的3D定位也非常有用,因为它们类似于组织在肿瘤巢和周围基质中的人类癌症(图S3A)。巨噬细胞的消耗是通过CSF-1R、Flt3和c-kit抑制剂PLX3397完成的,这些抑制剂在肿瘤植入后1周内通过鼠粮传递给小鼠,直到小鼠死亡。
在两种模型中,巨噬细胞的消耗引起肿瘤部位CD8 T细胞百分比的强烈增加,但自然杀伤细胞(NK)或其他骨髓细胞的百分比没有增加; 在原位PyMT模型中,CD4 T细胞数量增加,但在Met-1肿瘤中没有增加(图3A和图S3B)。尽管有这些变化,但仅在Met-1模型中,PLX3397在处死小鼠时可显着降低肿瘤负担(图3B和图S3C)。
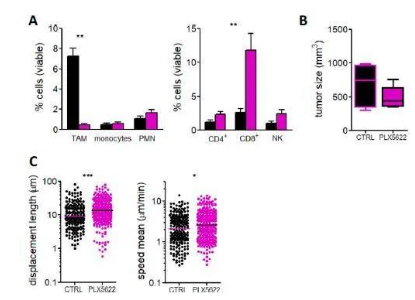
当作者分析新鲜肿瘤切片中的淋巴细胞运动时,作者注意到,与对照组相比,使用PLX3397处理的小鼠的CD8 T细胞平均速度和位移长度都有显著增加(图3C、图S3D和)。由于PLX3397可抑制CSF-1R、Flt3和c-kit,因此作者决定仅抑制CSF-1R检测是否对肿瘤中的免疫细胞发挥类似的作用。为此,作者使用了PLX5622特异性抑制CSF-1R酪氨酸激酶活性,其选择性是四种相关激酶的50倍。作者的结果清楚地表明,仅抑制CSF-1R就足以消除巨噬细胞,同时增加CD8 T细胞数量和迁移行为(图S4)。有趣的是,当作者考虑可以自由迁移的CD8 T细胞时(在20分钟的记录中显示位移长度超过20μm),作者注意到它们在对照和PLX3397处理的条件下都可以达到相同的最大速度(图S5A)。这表明可溶性微环境在抑制CD8 T细胞迁移中并没有发挥主要作用,而两种细胞之间的物理相互作用可能更为关键。然后,作者想知道PLX3397处理引起的运动增强是否会导致CD8 T细胞的基质封闭程度降低,从而更好地渗透到肿瘤岛中。事实上,在Met-1(图3D)和原位PyMT模型(图S5C)中都是如此。
此外,作者观察到位移长度和平均速度这两个运动参数都与CD8 T细胞浸润肿瘤巢的百分比直接相关(图3E和图S5C)。这些结果证实了作者在人类样品中的初步观察结果,即巨噬细胞除了在生长中的肿瘤中具有已知的抑制特性外,还可能通过将CD8 T细胞限制在基质中并限制它们与肿瘤细胞的接触来限制抗肿瘤反应的功效。
到此为止,作者主要通过共聚焦和流式分析发现在肿瘤和两种荷瘤小鼠中探讨了CD8 T细胞和巨噬细胞的相互影响。那后面作者又对哪些方面进行了研究呢,与抗PD-1治疗又有什么联系呢?由于篇幅限这里先卖个关子,预知后事如何,且听下回分解,那我们下周再见吧~~
文中的实验技术你也可以拥有!!!
1.细胞处理:我们拥有P2的细胞间,可以进行细胞培养、刺激。
2. 多因子检测:luminex平台热销pannel,筛选验证同步进行,省时省力
| 种属 |
检测技术 |
检测方向 |
货号 |
检测因子 |
| Human |
Luminex |
Cytokine |
LX-12007283 |
FGF-basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-1α, IL-2Rα, IL-3, IL-12(p40), IL-16, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, GRO-α, HGF, IFN-α2, LIF, MCP-3, IL-10, IL-12(p70), IL-13, IL-15, IL-17, IP-10, MCP-1(MCAF), MIG, β-NGF, SCF, SCGF-β, SDF-1α, MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF, CTACK, MIF, TRAIL, IL-18, M-CSF, TNF-β |
| Mouse |
Luminex |
Cytokine |
LX-M60009RDPD |
IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12 (p40), IL-12 (p70), IL-13, IL-17A, Eotaxin, G-CSF, GM-CSF, IFN-γ, KC, MCP-1 (MCAF), MIP-1α, MIP-1β, RANTES, TNF-α |
3. 流式染色:现可进行流式celesta 12色染色,细胞培养加染色一条龙。
4. 免疫组化:包括DAB染色、HE染色、Masson染色、免疫荧光(IF)
|



















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


