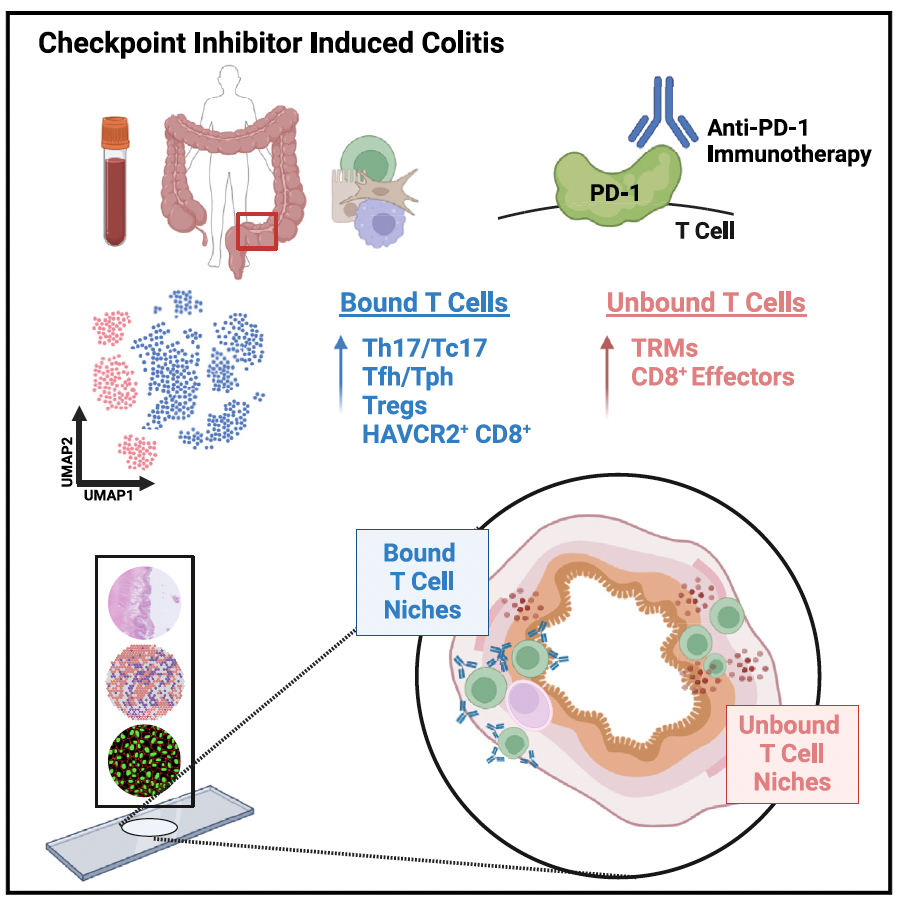
2024年5月,英国牛津大学约翰拉德克利夫医院研究团队在《Cancer Cell》杂志发表了题为“Tracking in situ checkpoint inhibitor-bound target T cells in patients with checkpoint-induced colitis.”的研究论文。
该研究综合利用单细胞RNA测序和CosMx单细胞空间转录组学技术等多组学方法追踪肠道组织中与检查点抑制剂 (CPI) 结合的T细胞,鉴定出与结肠炎发展相关的不同细胞亚型及其组织邻域,并进一步确定了致病相关的空间细胞社群特征。

关键词:多组学联用;细胞亚型鉴定;空间细胞社群/空间微域;空间生物标志物。
研究背景
免疫检查点抑制剂(CPIs)通过阻断检查点分子介导的调节性免疫信号,恢复了T细胞介导的癌细胞清除能力。然而,这些疗法也会引起一系列免疫相关不良事件(irAEs),其中以胃肠道炎症最常见,多达60%的患者会受到影响,导致医疗负担日益加重。但迄今为止,irAEs的致病机制仍有很多悬而未决的问题。
研究方法
在该研究中,研究人员利用多模态单细胞RNA测序、空间全转录组和单细胞空间转录组学技术追踪了CPI治疗下患者炎症和非炎症组织中的CPI结合T细胞,定义了与细胞损伤相关的组织微域,并阐释了CPI诱导的结肠炎的发生机制。
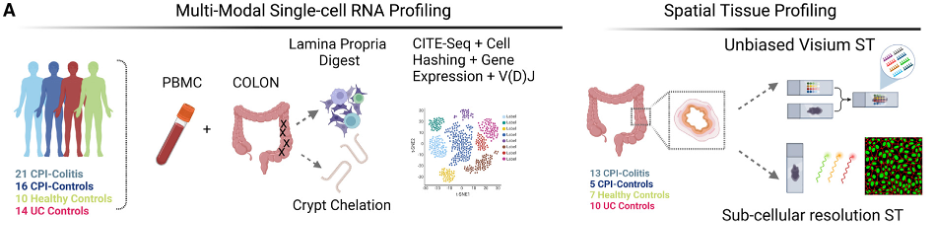
1 CPI诱导结肠炎的单细胞空间图谱
研究小组利用单细胞RNA测序鉴定出了结肠中的大部分细胞类型,并发现了CPI结肠炎特有的细胞类型(比如,CPI特异性 "活化 "成纤维细胞群),还发现了上皮细胞、胶质细胞、内皮细胞和巨噬细胞的表型转变。
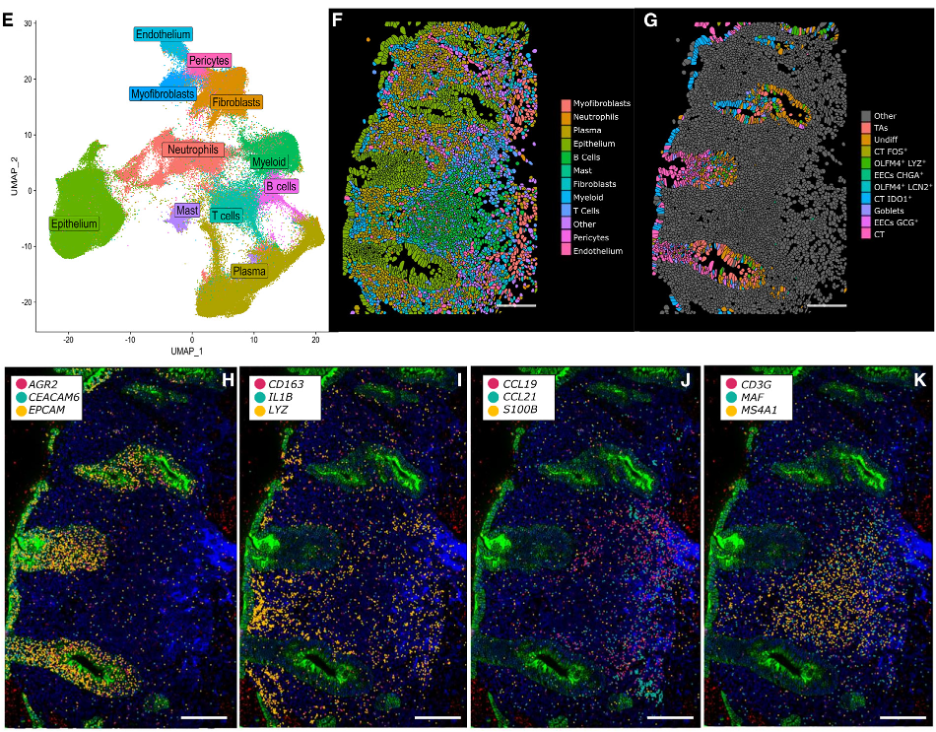
图 1. 基于CosMx单细胞空间转录组技术绘制了CPI结肠炎的单细胞空间图谱。
(E)利用CosMx单细胞空间转录组数据进行细胞聚类,UMAP聚类结果;(F和G)CPI结肠炎切片的代表性视野中不同细胞类型(F)和上皮细胞(G)的组织原位的空间分布。
(H-K)在代表性视野中,可视化展示了几个选定基因在组织原位不同类型的每个单细胞中的空间定位。黑色显示了分割的单细胞边界。
虽然基于spot的空间转录组学技术能够检测组织结构间的基因表达变化,但由于其分辨率低,难以准确检测分析细胞间相互作用和细胞状态。为了解决这些局限性,研究小组使用了真正单细胞分辨率的CosMx单细胞空间分子成像系统,对17个样本中的292,305个细胞进行了亚细胞分辨率的空间转录组分析,确定了所有关键细胞群,包括单细胞测序难以捕获的中性粒细胞以及更加精细的基质细胞、免疫细胞和上皮细胞亚群。研究人员还观察到在CPI结肠炎和UC两种状态下,“活化”的成纤维细胞都与免疫富集的组织区域共定位。
2 CPI结肠炎中结合CPI和不结合CPI的T细胞定位于不同的组织区域
为了识别检测结肠组织中靶向T细胞的空间位置,研究人员综合利用anti-IgG4和anti-CD3抗体区分了与CPI结合(CPI结合型)以及不与CPI结合(CPI自由型)的T细胞。利用CosMx单细胞空间转录组方法,研究人员分析发现,几类CPI结合型T细胞经常聚集在特定的固有层区域内。
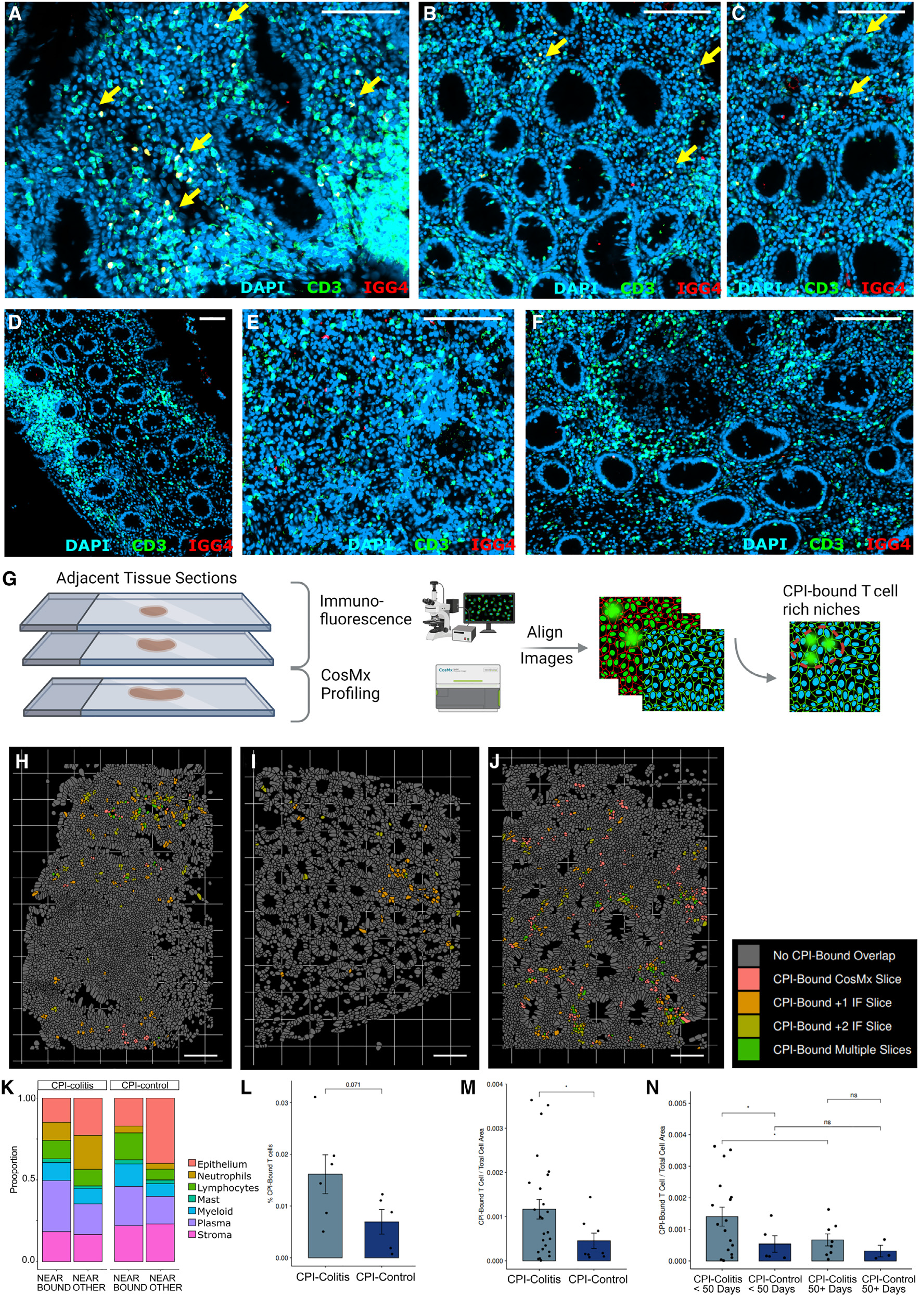
图 4. CosMx在单细胞水平在组织原位鉴定与CPI结合的T细胞。
(A-C)显示了CPI处理过的样本;(D-F)未处理的具有T细胞富集区的炎症对照样本。(G)利用CosMx单细胞空间转录组数据检测CPI结合型T细胞所处空间区域及其空间特征的实验策略示意图。(H-J)CosMx的代表性视场,显示了使用组织形态标记检测到的CPI结合型T细胞的空间分布。图中显示了固有膜区域(H)、小淋巴聚集体周围(I)以及固有膜和滤泡周围区域(J)中富集的CPI结合细胞。
研究人员继而利用CosMx单细胞空间转录组数据对CPI结肠炎样本和CPI对照样本中检测到的CPI结合型T细胞进行了量化分析。分析发现,与对照组相比,CPI结肠炎切片中CPI结合型T细胞的数量明显增加。
此外,研究人员还观察到,在样本采集50天以前接受CPI治疗的患者中,CPI结合型T细胞比时间间隔少于50天的患者少。综合上述发现表明:1. CPI治疗患者的结肠组织中存在CPI结合型细胞,但这些患者并没有发展为结肠炎,这表明仅结肠T细胞的靶向参与不足以诱发结肠炎;2. 在CPI结肠炎患者中,CPI靶标可及性或者用药时的参与性相较于未发展成结肠炎的患者会更高,并且可能具有临床预测意义。
3 CPI结肠炎中高度增殖的CPI自由型CD8+ T细胞富集了趋化性、促炎性组织细胞空间社群
为了更好地了解CPI结肠炎的组织损伤途径,并确定富含CPI靶细胞和无CPI T细胞的空间微域,研究人员利用CosMx单细胞空间转录组数据将组织划分为由细胞组成定义的不同空间微域。这样不仅能够得到每个细胞的空间位置和转录组表达状态,研究人员还可以将每个视场(FOV)中的不同细胞社群归类为不同的结构域。不仅展示出了已知的组织形态结构(如深隐窝、隐窝顶部、淋巴滤泡、粘膜肌肉、淋巴管和血管、血管周围区域等),还识别出多个固有层细胞空间域,否则仅靠组织病理学是无法识别这些精细的细胞域的。
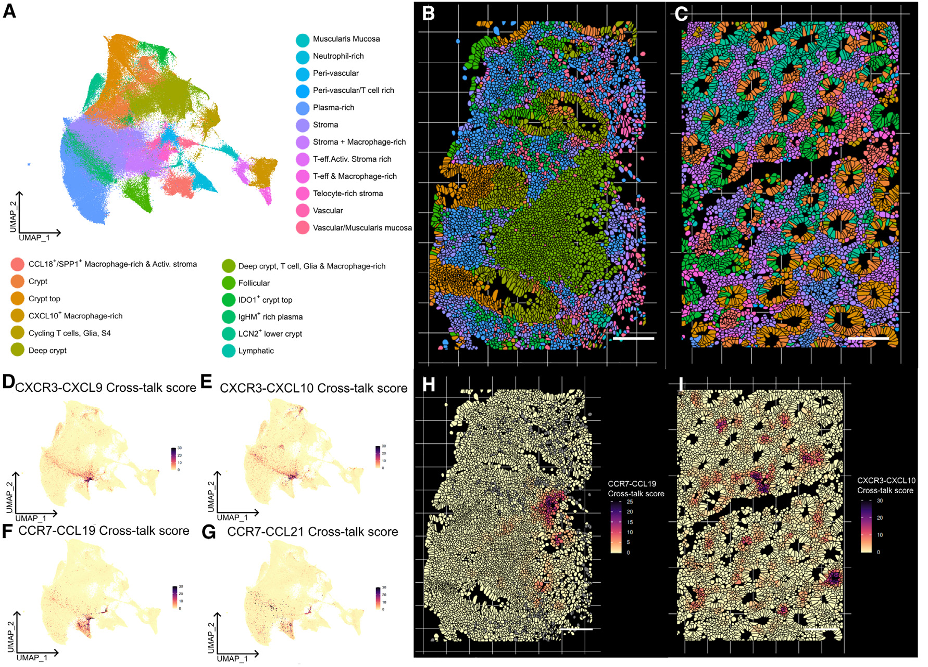
图 5 利用CosMx识别和发现CPI结肠炎的组织微域。
(A) 空间域的UMAP聚类,利用单个细胞的局部邻域细胞组成进行聚类。(B和C)CPI结肠炎中的不同空间域展示。
研究人员分析发现了CPI结肠炎组织所特有的几个空间域。CPI特异性空间域可以通过不同免疫亚群的组成来进行区分。研究人员进一步通过组织原位的细胞通讯分析发现,免疫细胞空间定位的多样性很大程度上可以由特异性空间域的趋化信号表达强度来解释,上皮细胞、活化的成纤维细胞、中性粒细胞、神经胶质细胞和内皮细胞参与了趋化域的协调工作。IFNg信号在这些空间区域局部富集。研究人员比较了CPI结合型和CPI自由型T细胞附近的细胞信号模式,发现通过CXCR3的趋化信号和IFNg信号在无CPI的T细胞附近显著富集,这表明活化的CPI自由型细胞直接促成了局部的促炎细胞因子环境。
4 多种免疫抑制途径的上调不足以抑制CPI结肠炎促炎隐窝的局部免疫反应
在CPI结肠炎上皮组织中,研究人员发现了两种独特的细胞类型:隐窝顶部面向管腔的IDO1+细胞和隐窝深部的LCN2+细胞。这两种细胞都显示出干扰素反应和上皮再生途径的表达上调,通常位于组织内整个特定的隐窝中。
IDO1+细胞可能通过犬尿氨酸途径促进Treg的极化,它们也常常与直接衬垫隐窝顶部细胞的巨噬细胞层相邻。研究人员将这类巨噬细胞定义为CPI结肠炎特异性的CD163+ M2亚型,它们特异性表达CCL18,可能进一步促进Treg的招募和分化。
综上所述,分析表明在CPI结肠炎中,单个隐窝和附近的细胞正积极通过增强Treg的极化/招募来抑制CD8介导的炎症。然而,CPI与Tregs的结合可能使其抑制活性不足。
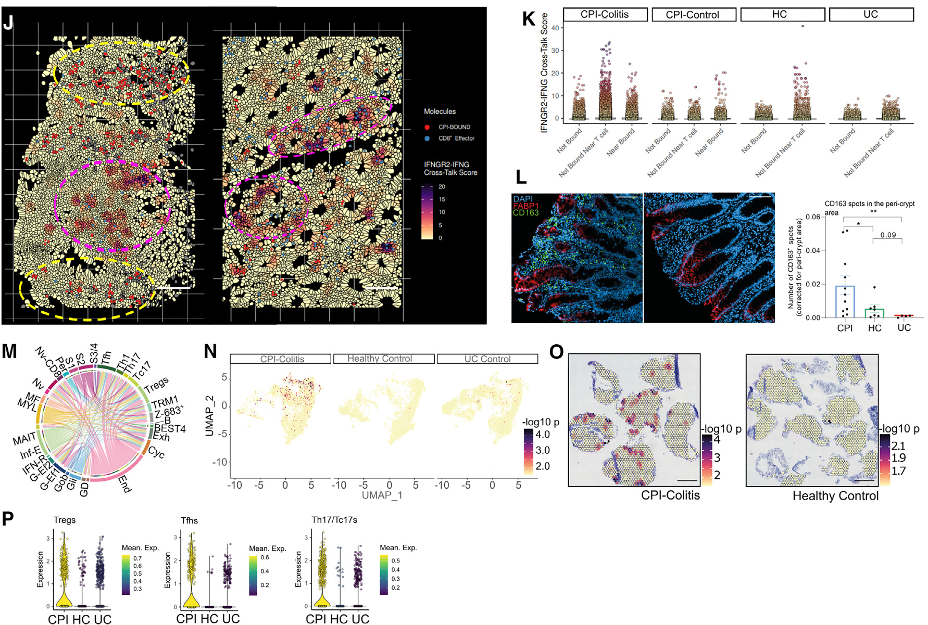
图 5 利用CosMx识别和发现CPI结肠炎的组织微域
(H和I)CPI结肠炎切片中局部细胞通讯信号。(H) CCR7-CCL19信号通路在淋巴结构附近富集,(I) CXCR3-CXCL10信号通路在固有层区域富集,这些区域通常有组织损伤的证据。
(J) CPI结合型T细胞(红色)或CD8+ 效应T细胞(蓝色)富集区域相关的局部IFNg 信号表达分布。富含CPI结合型细胞的区域用黄色标出,富含CD8+ 效应T 细胞的区域用紫色标出。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


