本周为大家带来的文献为2024年6月发表于J Immunother Cancer. (IF:10.3)的文献‘HDL-cholesterol confers sensitivity of immunotherapy in nasopharyngeal carcinoma via remodeling tumor-associated macrophages towards the M1 phenotype’。本文使用LabEx提供的Luminex检测服务。


(特别感谢Weina Wang和上海乐备实生物技术有限公司在整个Luminex检测过程中提供的宝贵指导)
文章介绍
尽管免疫检查点抑制剂(ICIs)在多种实体瘤,包括NPC的治疗中取得了重大进展,但只有约20%的NPC患者从单药免疫治疗中获益,且抗肿瘤反应并不持久。多个研究表明,脂质代谢可以调控肿瘤微环境,因此在癌症免疫疗法方面具有深远影响。其中脂蛋白,特别是HDL-C,可能通过抗炎功能、抗氧化能力和免疫调节能力在肿瘤发生和进展中发挥抑制作用。本文旨在探索决定鼻咽癌患者对免疫疗法反应的特定生物标志物。
实验方法
患者招募和样本收集:研究在中山大学肿瘤防治中心和桂林医学院第二附属医院招募了260名接受免疫治疗的NPC患者,分别组成训练队列(160人)和验证队列(100人)。纳入标准包括确诊为NPC,局部晚期、复发或转移性NPC且标准治疗失败,接受过ICI治疗,且有完整的血液指标记录。
血脂指标分析:评估了免疫治疗前后血清脂蛋白的变化,包括HDL-C、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、载脂蛋白A-1(ApoA1)和载脂蛋白B(ApoB),并研究这些指标与患者生存之间的关系
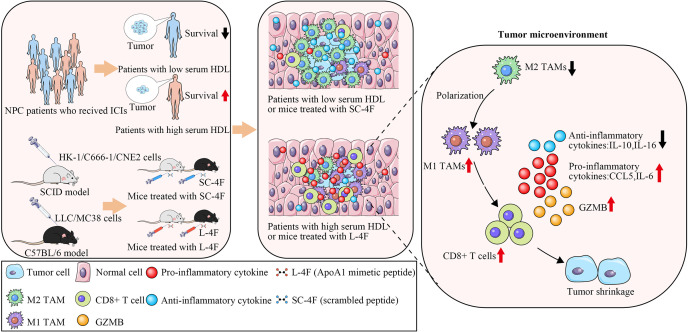
动物实验:通过多个实验探讨HDL-C影响免疫治疗反应的机制,使用ApoA1模拟物L-4F进行治疗,观察其对NPC移植瘤的抑制效果及其对巨噬细胞极化的影响。
重要发现
在免疫治疗后,脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇、甘油三酯、载脂蛋白A-1(ApoA1)和载脂蛋白B均显著改变。基线HDL-C或ApoA1较高,或者在免疫治疗后HDL-C或ApoA1增加的患者,其无进展生存期(PFS)更长,这一发现已在验证队列中得到证实(p<0.05)。多变量分析表明,基线HDL-C和免疫治疗后HDL-C升高是PFS优异的独立预测因子(p<0.05)。
为了阐明HDL增强免疫疗法的机制,研究者通过使用严重联合免疫缺陷(SCID)小鼠和C57BL/6小鼠进行模拟研究,继续探索HDL是否能对NPC中的TME产生积极影响。无论有无有效免疫成分存在,流式实验等其它数据表明HDL可以在体内诱导巨噬细胞极化来抑制肿瘤的生长。
通过免疫定位分析发现L-4F治疗组的肿瘤始终表现出明显较低的M2样巨噬细胞水平,进一步验证了L-4F在使M2样巨噬细胞向M1表型极化中的调节作用。
为了验证L-4F治疗可增加促炎细胞因子的产生并减少TAM中抗炎细胞因子的分泌,研究者从C57BL/6小鼠中分离了骨髓来源的巨噬细胞(BMDM)。然后将这些BMDM与LLC条件培养基中的L-4F或SC-4F一起孵育,从而诱导TAM。收集用L-4F或SC-4F处理的TAM的上清液进行评估。此外,为了确定L-4F即使在存在有效免疫成分的情况下也能调节促炎和抗炎细胞因子的产生,研究者还从接受L-4F或SC-4F治疗的免疫功能正常的C57BL/6小鼠中收集了PBMC,并通过LabEx提供的Luminex服务检测了细胞因子/趋化因子。
细胞因子测定表明,L-4F治疗后,M1相关细胞因子显著升高,M2相关细胞因子显著降低,与在SCID小鼠中观察到的结果一致(图A)。文氏图分析(图B、C)得到八种促炎细胞因子CCL1、CCL2、CCL5、CCL20、CXCL1、CX3CL1、GM-CSF 和白细胞介素 (IL)-6,显著升高。抗炎细胞因子 IL-10 和 IL-16 在接受 L-4F 治疗的 SCID 小鼠、C57BL/6 小鼠和 TAM 的样本中明显降低。因此可以得出L-4F 治疗可诱导细胞因子向更促炎的特征转变。

之后,研究者发现ApoA1模拟物L-4F能够抑制鼻咽癌(NPC)异种移植瘤的生长。这一效果与L-4F能够通过激活丝裂原活化蛋白激酶(MAPK)p38和核因子-κB(NF-κB)p65,将M2型巨噬细胞极化为M1型表型,从而减轻肿瘤微环境中的免疫抑制有关。重要的是,在高血浆HDL-C水平的NPC患者中,M2型巨噬细胞的数量显著减少,而M1型巨噬细胞和活化的CD8+T细胞的数量显著增加。
LabEx多因子现货清单













 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


