本周为大家带来的文献为发表于Cancer Immunol Immunother. (IF: 5.8)的” Carbon ion radiotherapy combined with immunotherapy: synergistic anti-tumor efficacy and preliminary investigation of ferroptosis”。本文使用了LabEx提供的Luminex检测服务。
放疗(RT)是主要的癌症治疗方式之一,可单独使用或与其他疗法联合使用,以提高反应率和生存率。碳离子放射治疗(CIRT)可为对放射治疗产生耐药性的患者带来令人满意的临床疗效。然而,碳离子对某些复发或难治性肿瘤的治疗效果仍然有限。因此,本文旨在评估免疫检查点抑制剂(ICIs)与 CIRT 联用的协同抗肿瘤效果。我们随后进行了一项初步调查,探讨了铁凋亡的参与情况。我们建立了肿瘤小鼠模型,并将 B16-OVA 细胞皮下接种到小鼠的双后腿侧面。小鼠被分为四组,分别接受CIRT、ICIs或联合治疗。之后,我们对可用的肿瘤组织进行了转录组测序(RNA-seq)、生物信息学分析和各种免疫相关实验,以研究各组协同抗癌效应的差异和潜在机制。联合疗法明显提高了小鼠的存活率,并抑制了局部和远处肿瘤的生长。根据生物信息学和 RNA-seq 数据,与其他组相比,联合治疗组的免疫相关通路和基因、免疫细胞浸润以及细胞因子和趋化因子的产生得到了最大程度的增强。最后,我们发现了铁突变在CIRT联合治疗过程中产生局部抗肿瘤协同作用的潜在作用。
LabEx提供的Luminex检测服务:
简言之,将肿瘤组织匀浆化,收集各治疗组的细胞上清液进行多细胞因子检测。细胞因子水平的评估采用 Luminex系统,使用31种小鼠细胞因子panel(LX-MultiDTM-31),并遵循制造商的建议。放射治疗8天后收集肿瘤进行多细胞因子检测。与对照组相比,在 CIRT、ICI 和联合治疗后,检测到照射肿瘤组织分泌了多种细胞因子和趋化因子。联合治疗后,放射肿瘤微环境中的细胞因子和趋化因子显著增加。
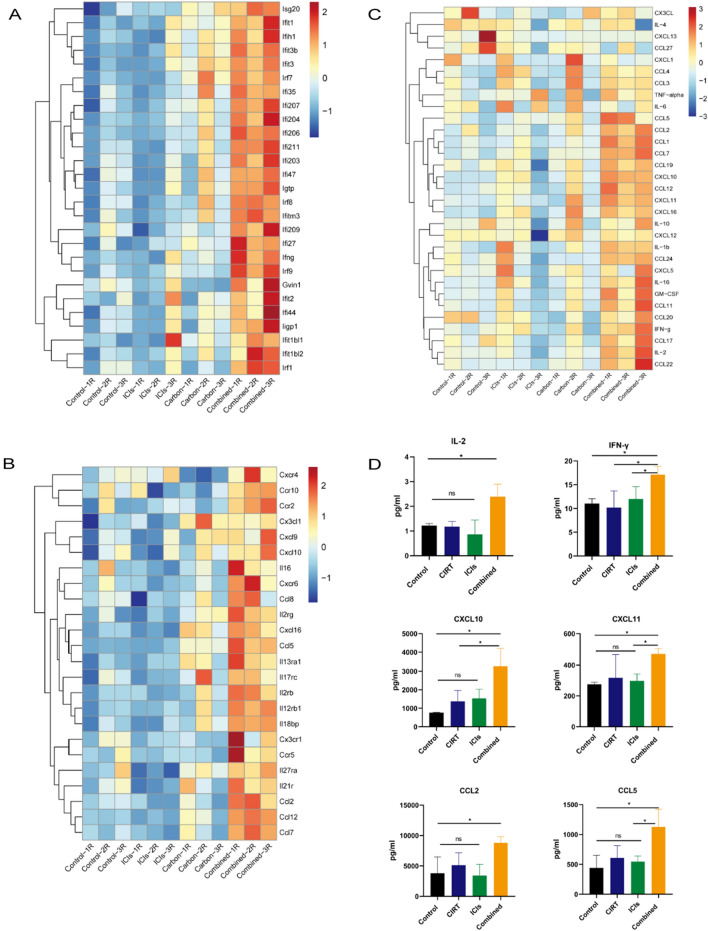
肿瘤中细胞因子和趋化因子的分泌情况。A, B 通过生物信息学分析各组干扰素反应及细胞因子和趋化因子基因的富集情况。C, D 使用多细胞因子检测法检测辐照肿瘤的细胞因子和趋化因子分泌。
重要发现:
CIRT与ICIs联合治疗的抗癌效果:研究表明,在小鼠模型中,碳离子放射治疗(CIRT)与免疫检查点抑制剂(ICIs)联合治疗的局部和远隔抗癌效果比单独使用碳离子或ICIs更强。
生物信息学分析显示,联合治疗组在免疫相关通路、分子和免疫细胞浸润方面的效果更显著。
免疫激活与免疫细胞浸润:流式细胞术、免疫荧光和多细胞因子检测结果证实,联合治疗组的免疫激活程度最高,特别是CD8+ T细胞的浸润显著增加。免疫细胞的浸润比例可预测预后、存活和转移,评估抗肿瘤反应的效果。
铁死亡在抗肿瘤中的作用:研究发现铁死亡可能有助于CIRT和ICIs联合治疗的抗肿瘤协同作用。联合治疗组的脂质和氨基酸代谢通路相关铁死亡标志物显著激活,表明铁死亡在CIRT联合治疗中的潜在作用。
肿瘤微环境的复杂性:联合治疗组的肿瘤微环境更复杂,分泌的细胞因子和趋化因子增加,特别是IL-2和IFN-γ等具有增强抗肿瘤效果的因子。CIRT激活I型干扰素通路,增加树突状细胞(DC)的活化和肿瘤抗原交叉呈递,促进T细胞启动。
CD8+ T细胞在抗肿瘤中的重要性:CD8单克隆抗体的应用揭示,联合治疗组的协同抗肿瘤效果被逆转,进一步证明了CD8细胞浸润对抗肿瘤效果的重要性。
CIRT与光子放疗的比较:研究发现碳离子比光子更有效地促进肿瘤细胞的免疫原性死亡。CIRT与ICIs联合治疗可能优于光子放疗,用于治疗放射抗性或复发性癌症。
铁死亡和辐射联合治疗的机制:铁死亡作为辐射和其他治疗方法的共调控因素,进一步研究其在CIRT联合治疗中的特定分子机制至关重要。
远隔效应(Abscopal effect):CIRT联合ICIs可诱导远隔效应,CD8+ T细胞在此过程中起关键作用,但具体机制尚未明确,需要进一步研究。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


