本文是针对论文《NK细胞和实体瘤:治疗潜力和持续存在的障碍(NK cells and solid tumors: therapeutic potential and persisting obstacles)》该综述于2022年11月发表于Molecular Cancer。

背景介绍
前言:自然杀伤(NK)细胞是具有强大细胞毒性活性的先天性淋巴细胞,它作为潜在的抗癌疗法引起关注,但NK细胞输注在实体瘤患者中的治疗效果却有限。治疗过程受到几种因素的阻碍,例如肿瘤浸润不充分和在肿瘤微环境(TME)中的持续/激活。TME的一些代谢特征,包括缺氧以及腺苷、活性氧和前列腺素水平的升高,对NK细胞的活性都有负面影响。此外,癌症相关的成纤维细胞、肿瘤相关的巨噬细胞、骨髓源性抑制细胞和调节性T细胞积极抑制NK细胞依赖的抗癌免疫。
综述目的:回顾在实体瘤中抑制NK细胞的代谢和细胞障碍,讨论规避这些障碍的潜在策略,以确保治疗效果。
综述聚焦
一、NK细胞抗癌活性的环境障碍
一些环境因素会阻止过继性转移的NK细胞聚集到实体瘤的TME中,限制它们在其中的持续存在和/或抑制它们的细胞毒性,例如NK细胞贩运受损以及TME代谢具有的免疫抑制作用。

图1 影响NK细胞最佳细胞活性的环境因素
1. 受损的NK细胞贩运
多种因素调控NK细胞贩运,包括整合素、选择素和趋化因子受体。在实体瘤中,NK细胞会招募CXCR3。IFN或IFNG通路刺激CXCR3的配体CXCL9,CXCL10和CXCL11分泌,被证实在多种肿瘤环境中和NK细胞浸润有关。因此,旨在提高NK细胞的CXCR3表达和/或在TME中分泌CXCR3配体的策略可能会导致NK细胞被招募到实体瘤的肿瘤微环境中。其他趋化因子受体包括CXCR4,CCR7,CX3CR1都被证实可以将NK细胞招募到实体瘤微环境中。
2. 缺氧
因为血管缺陷和局部需氧量的增加,实体瘤的肿瘤微环境常处于缺氧状态。这种环境会抑制ERK信号,减少STAT3的目标基因,促进多种损伤NK细胞功能的表面受体。这对NK细胞造成了多种不利影响:(1)抑制ERK信号,减少STAT3表达的目标基因;(2)促进多种损伤NK细胞功能的表面受体;(3)引起NK细胞线粒体破碎;(4)通过多种免疫抑制细胞干扰NK细胞功能。逆转缺氧是恢复实体瘤TME中NK细胞功能的一个潜在策略。另一种方法是使NK细胞对低氧水平的耐受性更强。
3. 活性氧物种(ROS)
ROS在实体瘤微环境中富集,可以通过多个包括免疫逃逸在内的机制促进疾病发展。事实上,NK细胞对ROS的基因毒性和细胞毒性作用特别敏感。除了在高ROS水平下产生的细胞毒性机制,ROS引起的损害NK细胞抗癌活性的机制之一与NK细胞膜性质变化有关。具体表现为ROS促进NK细胞表面阴离子点恶化的积累,限制了它们与目标肿瘤细胞的粘附。除了清除ROS和抑制ROS产生系统之外,提高NK细胞对ROS的耐受性也是一种抗癌的潜在方法。作为强效NK细胞激活剂的IL15,可以通过MTOR依赖性机制上调NK细胞中的硫氧还蛋白(TXN),增加细胞表面还原性硫醇的可用性,最终在环境氧化压力下仍能保持细胞毒性功能。
4. 前列腺素E2(PGE2)
各种肿瘤的出现和发展都是在慢性、惰性炎症反应的背景下进行的,这些炎症反应最终促进了免疫逃避,这就是通常所说的肿瘤促进性炎症(TPI)。PTGER4(EP4)激动剂已被证明能有效地抑制小鼠NK细胞产生IFNG和对血清趋化因子的趋化反应。在临床前模型中,EP4的药理抑制可以保护NK细胞免受PGE2的免疫抑制作用,从而保留效应功能和抗转移活性。
5. 腺苷
腺苷是ATP降解的最终产品,因为肿瘤微环境导致免疫细胞压力和死亡,大量ATP释放积累在细胞外环境中。腺苷结合免疫细胞上的腺苷A2a受体(ADORA2A)或者腺苷A2b受体(ADORA2B),调控免疫抑制反应。这个过程已被证实可以抑制NK细胞参与的细胞因子释放。中断A2AR和/或A2BR激活的药理和遗传策略已被证明可以在各种实验环境中防止腺苷引起的NK细胞功能障碍。
二、影响NK细胞活性的免疫和基质障碍
一些TME的免疫和基质区间也会抑制NK细胞的效应功能。因此,靶向包括Treg,TAMs,MDSCs和CAFs在内的细胞群是一种赋予肿瘤浸润性NK细胞效应功能的潜在方式。
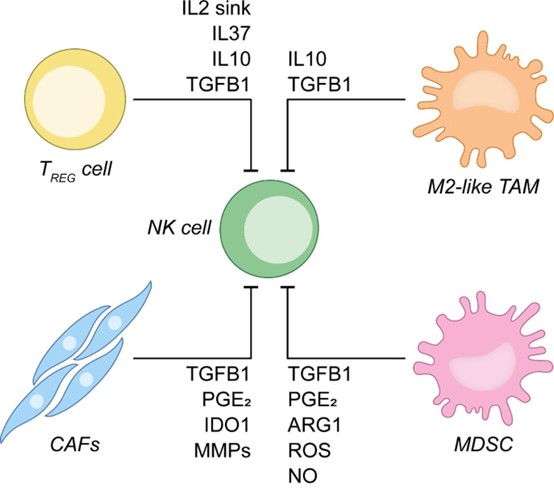
图2 影响NK细胞最佳细胞活性的免疫和基质障碍
1. 调节性T细胞(Treg)
肿瘤浸润的Treg细胞通过直接的、依赖接触的途径以及直接和间接的体液机制介导强大的免疫抑制作用。人类和小鼠的NK细胞对TREG细胞介导的免疫抑制高度敏感,通常导致NK细胞激活受体的表达减少,共同抑制受体的上调。
2. 肿瘤相关巨噬细胞(TAM)
TAMs是肿瘤微环境中非常具有可塑性,可以适应一系列的表型和功能特征,如促炎症状态(M1样TAMs)或抗炎症状态(M2样TAMs)。从小鼠乳腺癌中分离出来的M2样TAMs已被证明能有效地抑制NK细胞的细胞毒性。
3. 髓源性抑制细胞(MDSCs)
MDSCs可以被分为CD11b+CD14+CD33+HLA-DRlow/neg单核细胞(M)-MDSCs或CD11b+CD15+HLA-DRlowCD66b+粒细胞(G)-或多形核(PMN)-MDSCs。在小鼠癌症模型中,CD11b+Gr1+ MDSCs出现频率与NK细胞受体表达量、IFNG和PRF1的量成反比
4. 癌症相关成纤维细胞(CAFs)
肿瘤被高度可塑和功能异质性的CAFs种群浸润,它可以直接抑制免疫效应细胞,通过产生大量TGFB1或者下调PVR细胞(NK细胞受体之一)粘附性,抑制NK细胞功能。
原文链接: https://pubmed.ncbi.nlm.nih.gov/36319998/#:~:text=NK%20cells%20and%20solid%20tumors%3A%20therapeutic%20potential%20and,have%20recently%20attracted%20attention%20as%20potential%20anticancer%20therapeutics.







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


