
膀胱癌(BC)是世界上最普遍的癌症之一,据估计,20201年美国有81400例新诊断病例和17980例死亡。单细胞测序技术显著地提高了我们对膀胱癌遗传图谱和分子特征的认识。本篇文章通过单细胞转录组分析,确定 CD39 是膀胱癌的潜在治疗靶点。研究发现,在皮下肿瘤模型和原位抑制 CD39 能够抑制膀胱癌的生长,提高膀胱癌小鼠的总生存期。研究通过单细胞RNA测序,发现CD39i增加了肿瘤内NK细胞、常规1型树突状细胞(cDC1)和CD8 + T细胞,降低了Treg丰度。该文章“Single cell sequencing reveals that CD39 inhibition mediates changes to the tumor microenvironment”于 2022年10月27日发表在nature communications杂志。
一、CD39在BC中过表达,且主要局限于肿瘤基质区域
我们的研究基于8 个肿瘤样本和3个癌旁样本的单细胞图谱,通过TCGA BLCA bulk seq、单细胞转录组和RNA-seq数据集的综合分析,我们发现CD39在BC组织中显著过表达,并与免疫抑制相关。我们观察了CD39的表达分布,结果表明CD39主要表达于内皮细胞、SMC及周围细胞、髓系细胞、成纤维细胞以及淋巴细胞。先前的研究表明,T细胞表面CD39的上调预示着T细胞功能障碍的终末期。通过单细胞转录组,我们发现肿瘤浸润的T细胞,无论是CD4 +还是CD8 +,都显示出更高水平的CD39,以及LAG3的增加,LAG3是T细胞衰竭的另一个标志物。采用免疫组化(IHC)方法对BC和癌旁组织进行CD39染色,发现BC组织中CD39的表达明显高于正常膀胱组织。此外,CD39高表达的BC患者预后较差。

二、在体CD39i可抑制BC进展
为了验证CD39的致癌作用,我们用POM-1处理MB49细胞(mcd49) (C57BL/6 J)小鼠皮下肿瘤模型和小鼠膀胱原位肿瘤模型。结果表明,CD39i能显著抑制肿瘤生长,提高小鼠存活率。在小鼠原位膀胱癌模型中,我们发现CD39i治疗可以显著降低肿瘤的最大横截面积和小鼠膀胱重量,再次证明CD39i治疗可以显著抑制肿瘤生长。CD39i治疗诱导肿瘤组织中免疫细胞浸润明显增加,包括CD45 +细胞、CD4 +和CD8 + T细胞。
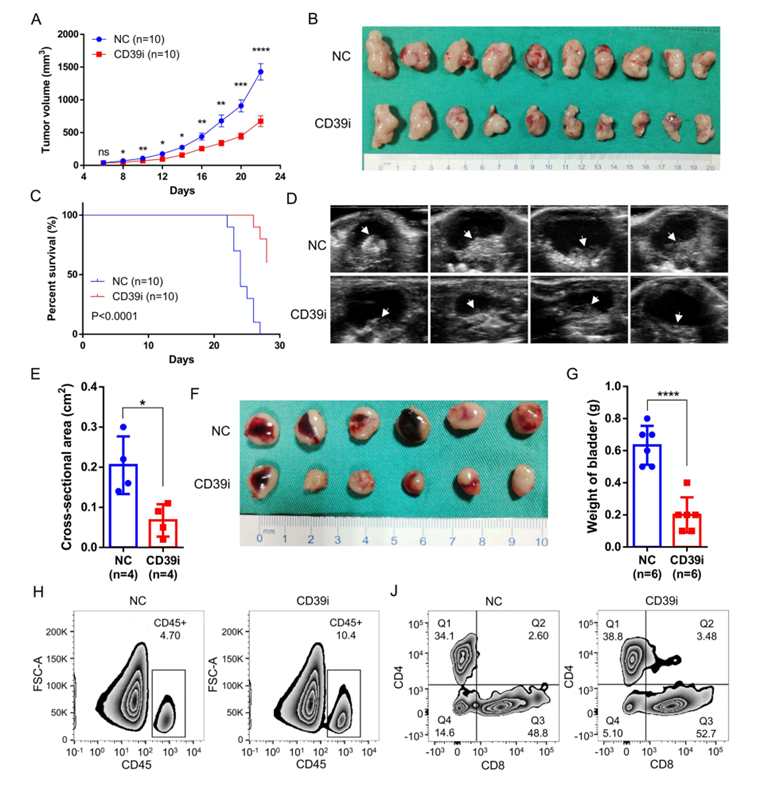
三、CD39i处理激活CD8 + T细胞,促进T细胞扩增
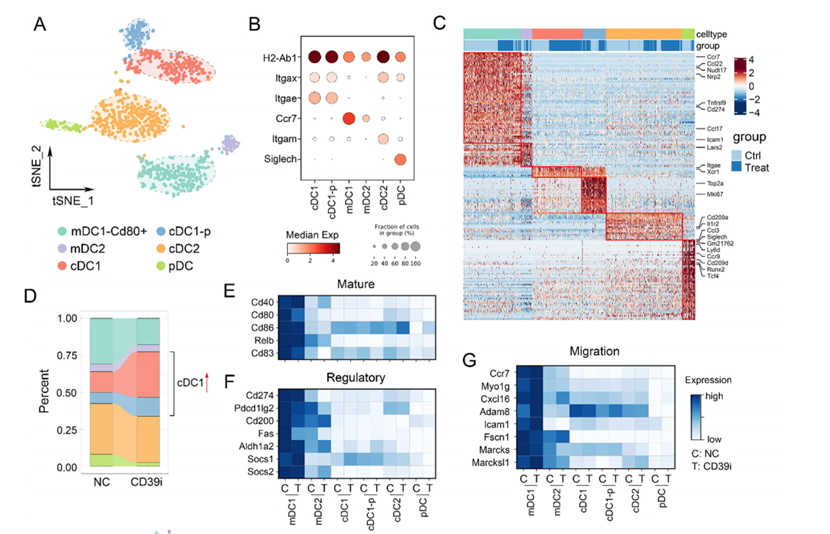
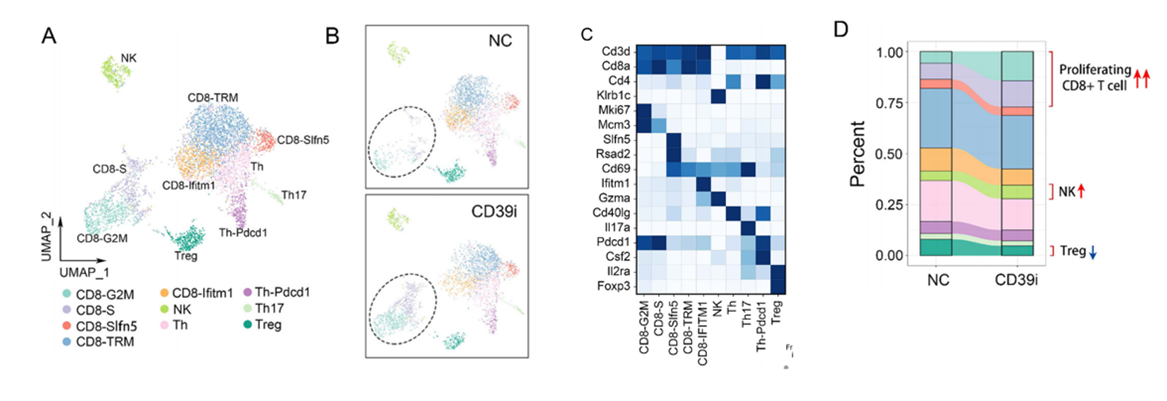
CD39i治疗后DC亚群和单核巨噬细胞亚群比例发生改变。根据经典标记,DC的重新聚类确定了6个亚群,包括迁移性DC2 (mDC2)、迁移性DC1−CD80 +(mDC1−CD80 +)、cDC1、cDC1-增殖性(cDC1-p)、常规2型树突状细胞(cDC2)和浆细胞样DC (pDC)(图3A-C)。cDC1-p是指处于G2M或S期的cDC1 (Mki67 + /Mcm2 +),在cDC1中占相当大的比例。来自CD39i治疗的肿瘤的DC亚群显示出巨大的变化,体现在mDC1 CD80 +和pDC减少,同时cDC1和cDC1-p比例显著增加。为了进一步研究CD39i介导的T细胞变化,将lym细胞聚成10个簇,我们发现CD39i引起的最显著的变化是循环CD8 + T细胞(CD8- g2m和CD8- s)的增加。
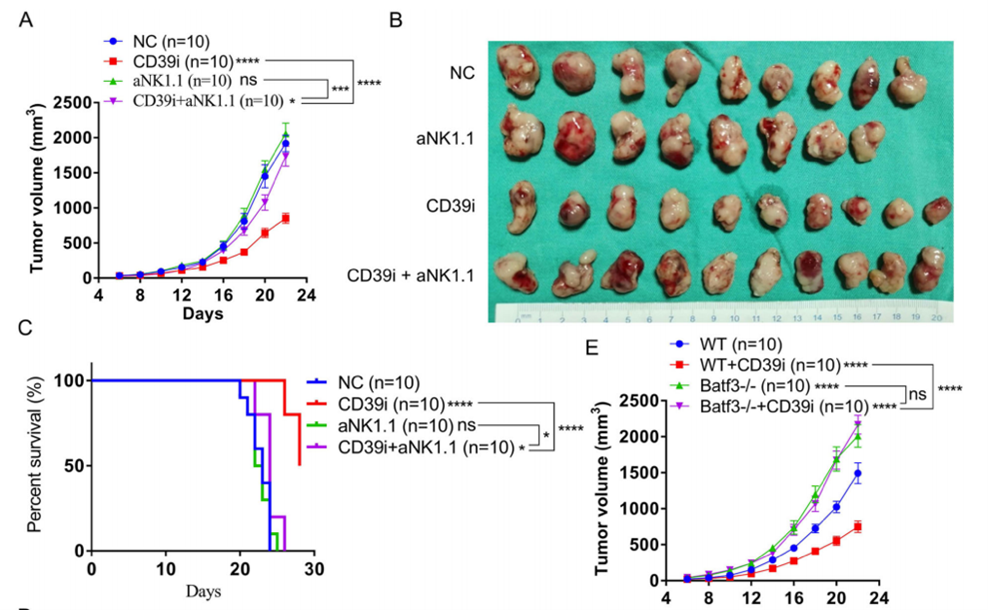
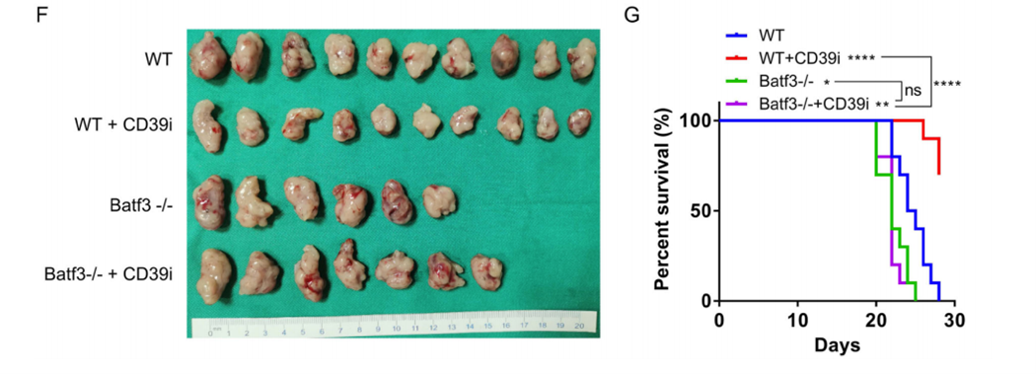
四、在体NK细胞的耗竭逆转CD39i的抗肿瘤作用
为了验证CD39i抑制BC进展的潜在机制,我们再次构建小鼠皮下肿瘤模型。结果显示CD39i能显著抑制肿瘤生长,提高小鼠的总生存率。但CD39i在NK细胞减少小鼠中的作用显著降低。上述结果表明,NK细胞是CD39i发挥抗肿瘤作用的关键。
五、以CD39i为基础的联合治疗
基于CD39和几种协同抑制受体(PD1、LAG3和TIM3)的表达水平在CD8 + T细胞激活后上调。因此,与aPD1或aPD-L1联合治疗可能是更好的选择。在联合策略中,CD39i + CIS和aPD1 + CIS在抑制肿瘤生长和改善预后方面具有显著的协同作用,而CD39i + aPD1则没有。此外,我们发现CD39i、CIS和aPD1联合使用在体内具有最强的抗肿瘤疗效。由于CIS是目前最常用的化疗药物,因此CD39i或CD39i与aPD-1的组合可以作为化疗后的后续治疗。
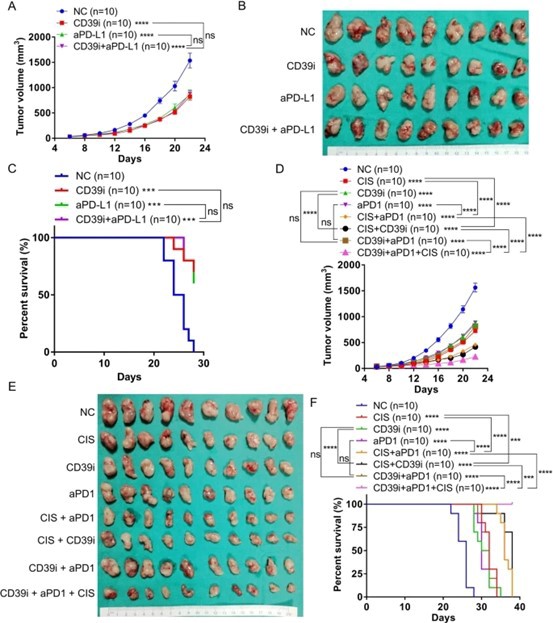
总之,使用单细胞测序,我们提供了一个 CD39i介导的肿瘤微环境变化的全景视图,增强了我们对CD39i作用的理解。CD39i通过增加浸润NK细胞、cDC1和循环CD8 + T细胞的比例发挥抗肿瘤作用肿瘤。同时 我们的工作提供了一种基于CD39i的联合方案,为临床转化奠定坚实基础。
原文链接:https://doi.org/10.1038/s41467-022-34495-z












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


