
一.研究背景
背景:在炎症刺激下,中性粒细胞从循环血液中迁移到受感染的组织中,通过吞噬、杀死和消化细菌和病原体来保护宿主。因为具有异质性,它们的分化和成熟可以产生不同的细胞亚群,具有不同的功能。传统上中性粒细胞的分类无法捕捉到完整的区系,重叠的细胞亚群因此命名混乱,引起对其功能和发育的争议。此外,一些中性粒细胞亚群的功能和异质性也具有差异性。
目的:本文探索中性粒细胞在稳定状态和细菌感染期间的成熟、功能和命运决定的全面转录景观,为研究中性粒细胞相关疾病机制、生物标志物和单细胞治疗建立参考模型和框架。
方法:通过单细胞RNA测序(scRNA-seq),以单细胞的分辨率来剖析小鼠BM、外周血和脾脏中的中性粒细胞群。
二.稳定状态下的转录景观
1.研究模型
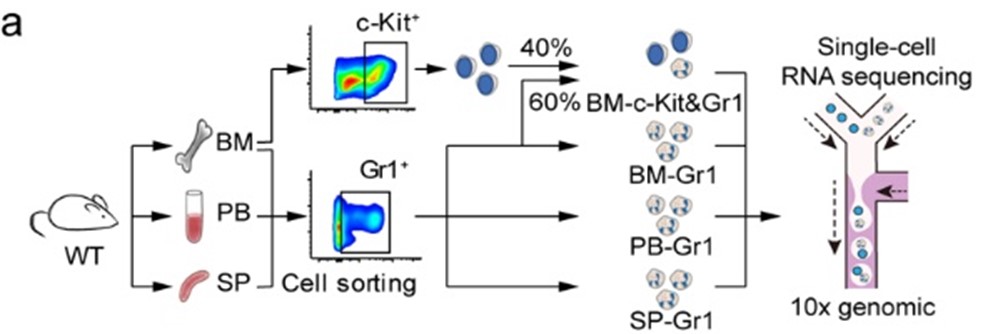
研究者构建的实验模型如图1所示。通过FACS从骨髓(BM-Gr1)、外周血(PB-Gr1)和脾脏(SP-Gr1)分离出Gr1+细胞。为了捕捉中性粒细胞成熟的整个光谱,并确定潜在的中性粒细胞群具有较低的Gr1抗原(主要是Ly6G)表达,每个样本中也包括Gr1low和少数Gr1-细胞。
2.稳定态下的小鼠中性粒细胞
实验获得了19,582个高质量细胞,每个细胞平均有1,241个基因,结果在所有细胞中共检测到18,269个小鼠基因,共确定了七个主要的细胞群,划分为八个聚类。图c所示,G0-4主要来自BM(骨髓),代表在BM中分化的中性粒细胞,而G5a-c主要来自PB(外周组织样本)。
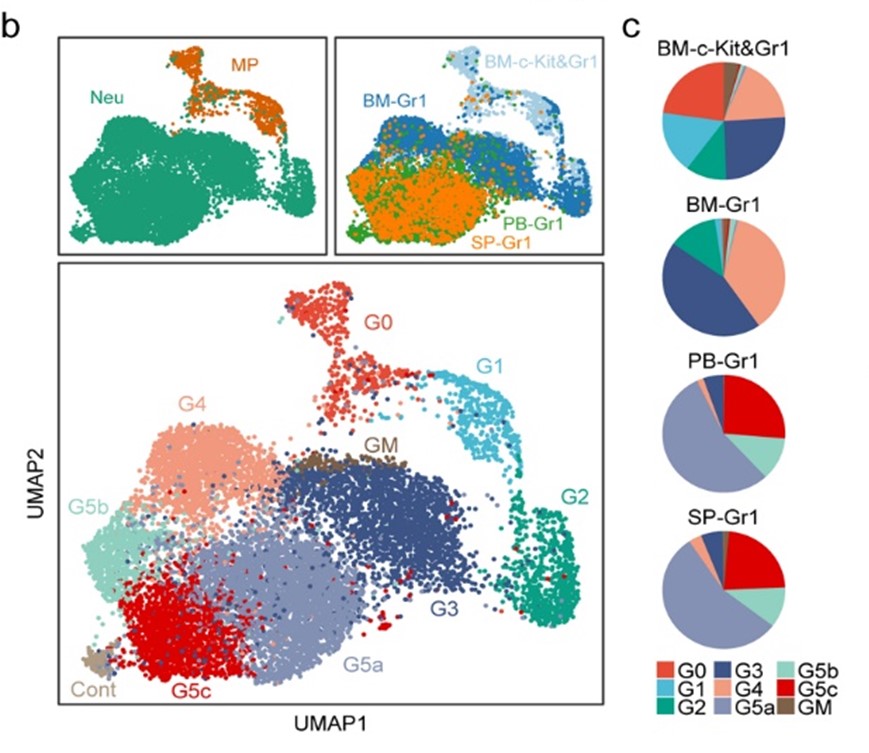
3.中性粒细胞分化和成熟的轨迹
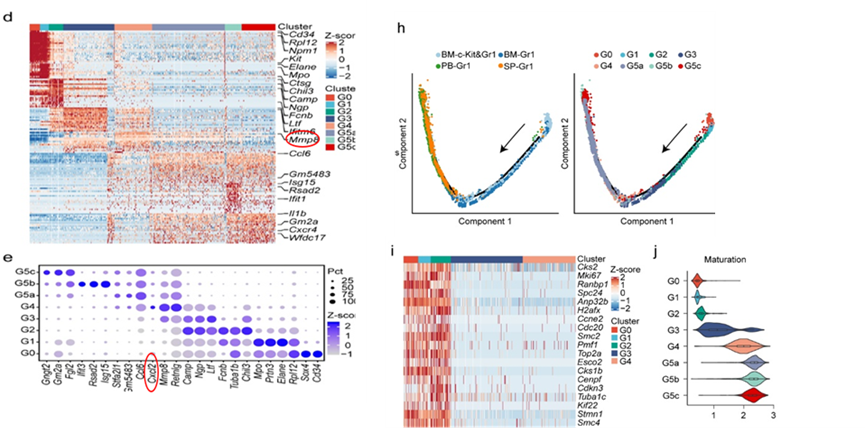
每个群体表达的典型基因如图2e所示。中性粒细胞的分化和成熟发生在一个紧密的轨迹上,从BM的G1细胞开始,到PB和脾脏的G5细胞结束(图h)。G1至G2细胞经历了积极的增殖,此后细胞分裂突然停止(图i)。在BM的中性粒细胞分化结束后,更成熟的G4细胞群高度表达Mmp8和Cxcl2,分别参与宿主防御和中性粒细胞动员(图d、e)。最成熟的中性粒细胞G5细胞占外周组织中大多数,而G4细胞在BM成熟(G0至G4)中性粒细胞中显示出最高的成熟度得分(图j)。
4.scRNA-seq-形态学的相关性
中性粒细胞的成熟通常遵循五个主要的形态学阶段:骨髓细胞(MBs)、前骨髓细胞(PMs)、骨髓细胞(MCs)、元骨髓细胞(MMs)、带状中性粒细胞和分段中性粒细胞(BC/SCs)。通过比较,得到MB是G0/G1,PM是G1,MC是G1/G2,MM是G2,而BC/SC是G3/G4的混合物。
三.细胞感染状态下的转录景观
1.细菌感染促使中性粒细胞功能增强而不影响整体异质性
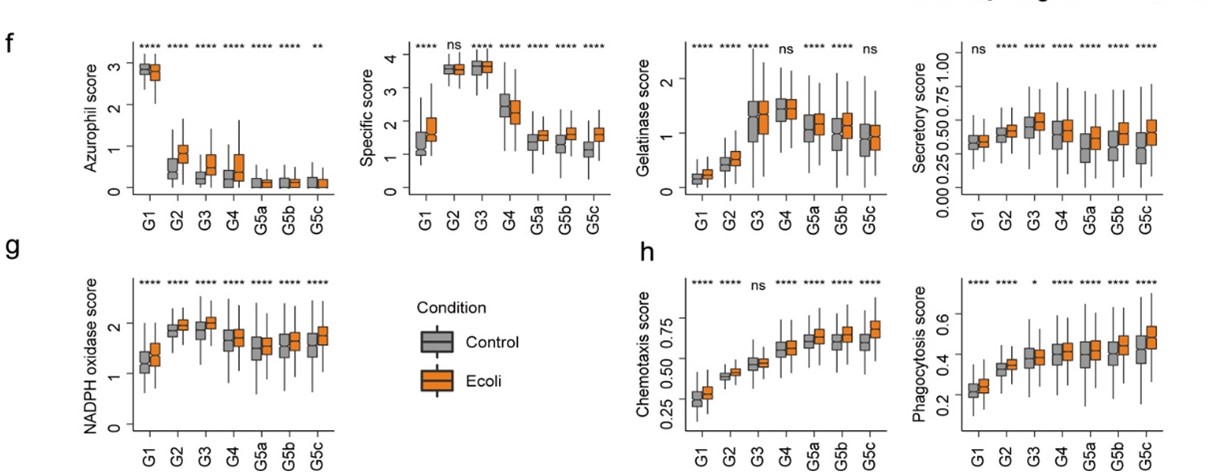
研究者使用大肠杆菌感染宿主,继续研究细菌感染如何在肝脏和腹腔中影响中性粒细胞。小鼠每个亚群中的细胞在感染后仍保留核心特征基因,每个中性粒细胞群体的身份得到了维持。同时结果显示感染上调了许多基因(图d)。在成熟的细胞亚群包括G4和G5中性粒细胞中,细菌感染引起了细胞因子生产和分泌基因的显著上调 (图e)。此外,感染增加了颗粒蛋白(图f)和NADPH氧化酶复合物(图g)的表达,加强了吞噬作用和趋化作用(图h)等与杀菌有关的功能。结果表明中性粒细胞与病原体清除有关的基因在成熟期的每个阶段都被上调,最大化宿主的防御机制。

2.细菌感染加速了G1细胞分裂和有丝分裂后的成熟,但不改变中性粒细胞的整体分化
在细菌感染期间,中性粒细胞种群明显扩大。然而,在感染状态下,中性粒细胞分化和成熟的轨迹基本保持不变(图a)。通过比较表达不同含量的Ly6G和CXCR4的中性粒细胞所占百分比可以得到,在感染宿主中,Ly6Ghi CXCR4low细胞的比例明显减少,Ly6Glow CXCR4hi和Ly6Ghi CXCR4hi细胞在BM和PB中都占优势(图f)。这些中性粒细胞按照类似的动态模式动员到周边区域,但只经过两天而不是三天,因此感染宿主有丝分裂后中性粒细胞成熟期的急剧减少(图f)。
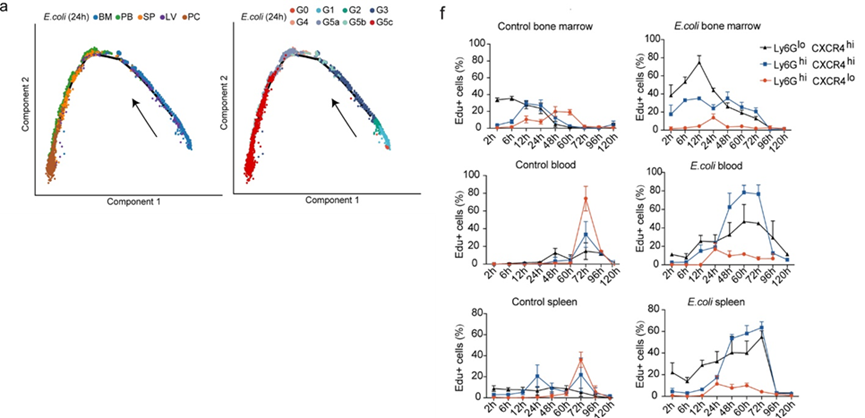
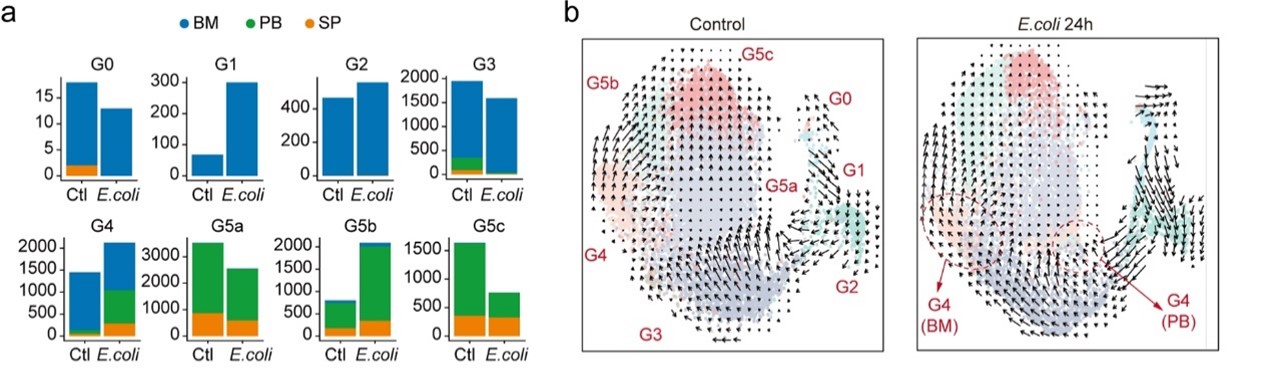
3.细菌感染重新规划中性粒细胞种群结构和亚种群之间的动态转换
通过速度分析可以得到,细胞常态和细胞感染状态下,BM G2细胞的比例保持不变,表明G1细胞的流入和G2细胞向G3细胞的转化是平衡的(图a)。然而G3细胞向G5a细胞的转化被抑制,被感染宿主的G3细胞主要分化为G4细胞(图b)。此外,感染明显抑制了G5a和G5b向G5c的转化,导致大肠杆菌挑战的宿主的G5c数量减少。
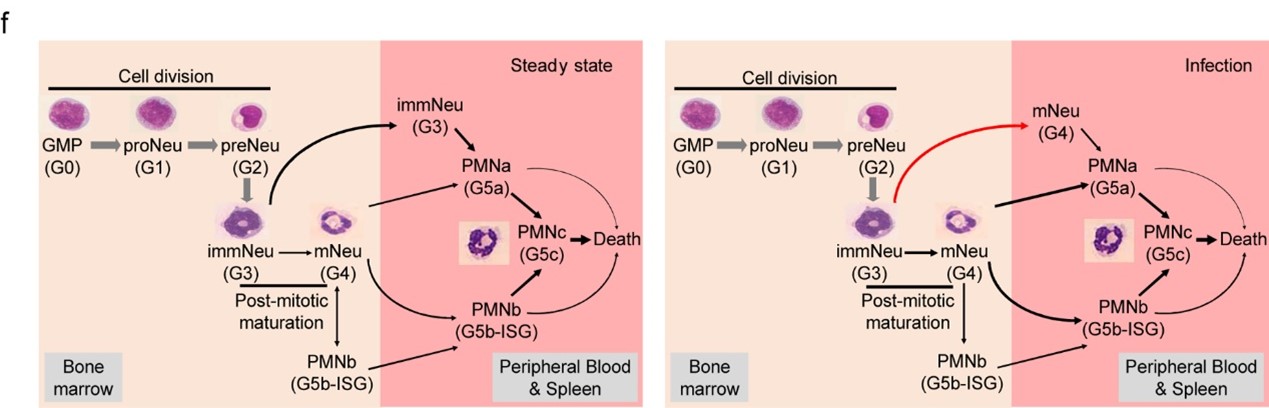
4.动态转化模型
综合此前的研究,作者总结出了稳定态和感染态下的中性粒细胞亚群间的动态转化模型(图f)。PB包含三个主要的中性粒细胞亚群,G5a、G5b和G5c,它们代表了最成熟的中性粒细胞,具有典型的多形核形态,分别被命名为PMNa、PMNb和PMNc(图f)。这里描述的G0、G1、G2、G3和G4集群分别与骨髓GMP、proNeu、preNeu、未成熟Neu(immNeu)和成熟Neu(mNeu)一致。在感染期间,从immNeu到PMNa细胞的转化被抑制,被感染的宿主中的immNeu细胞主要分化为mNeu细胞。
原文链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7442692/












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


