综述文献解析:CD8+ T细胞亚群在抗肿瘤免疫中的作用
(The Roles of CD8+ T Cell Subsets in Antitumor Immunity)

导读
本文是针对论文《CD8+ T细胞亚群在抗肿瘤免疫中的作用(The Roles of CD8+ T Cell Subsets in Antitumor Immunity)》的一篇解析,该论文于2020年7月发表于《细胞生物学的发展趋势(Trends in Cell Biology)》。
综述背景:相关研究表明CD8+T细胞在抗肿瘤治疗过程中起到至关重要的作用,与CD4+T细胞相似, CD8+T细胞也有多个亚型,不同的亚型它的产生过程和功能是有所区别的,比如,并不是所有亚群都具有细胞毒性功能并产生IFN-γ。所以深入了解不同CD8+T细胞亚型在抗肿瘤过程中的作用是非常迫切的。
综述目的:阐述不同Tc亚型的产生与作用机制,强调其在抗肿瘤免疫过程中的作用,为开发新的肿瘤治疗策略,改善癌症的治疗和预后等提供理论基础。
综述思路

综述聚焦
1.CD8+T细胞有多个亚群,并不是所有亚群都具有细胞毒功能并产生IFN-γ。
2.在TME中检测到了各种不同的TC亚群,根据亚群的不同,与预后或正相关或负相关。
3.在过继免疫治疗癌症的背景下,转移的T细胞亚群对肿瘤的控制程度有很大影响。
综述内容
第一部分 前言
前言部分作者主要介绍CD8+T细胞的研究进展与写这篇综述的目的。目前已经发现多个CD8+T细胞的亚群,并不是所有的亚群的功能都相同。值得关注的是,在肿瘤微环境(TME)中也检测到了这些亚群,影响着抗肿瘤反应和患者预后。通过这样的综述来讨论Tc亚群在TME、过继免疫治疗癌症中的作用。
第二部分 主体
一、CD8+T细胞
T细胞在协调整体免疫反应还有直接杀死受损细胞方面发挥着重要作用,这些功能分别会有CD4+T细胞还有CD8+T细胞来介导。目前已经确定了几种不同的CD4+T细胞亚型的特点。对于CD8+T细胞通常被认为是一个统一的细胞群体,通过分泌大量的IFN-γ和蛋白酶颗粒酶B,杀死感染或肿瘤细胞,但是并不是所有的CD8+T细胞亚型都具有相同的作用,所以目前对CD8+T细胞的亚型的了解还不够明确,在这篇综述中,提供了CD8+T每个亚型的不同作用的概述,并集中在它们引起的抗肿瘤免疫反应上。
二、CD8+T细胞有哪些亚型?特征是什么?
在体外CD8+Tc谱系的分化需要特定的细胞因子来调节的,这些细胞因子激活信号级联反应,导致特定转录因子的表达,从而促进不同亚型的形成,并且每个亚群会表达不同的细胞因子,比如一些亚群具有较差得细胞溶解能力。接下来针对不同亚型的特征进行阐述。(结合图1与表1)

图1.CD8+T细胞亚群。在细胞因子存在的情况下,原始CD8+T细胞最初暴露于抗原时,可以分化为各种不同的Tc亚群,每个亚群都产生不同的细胞因子。
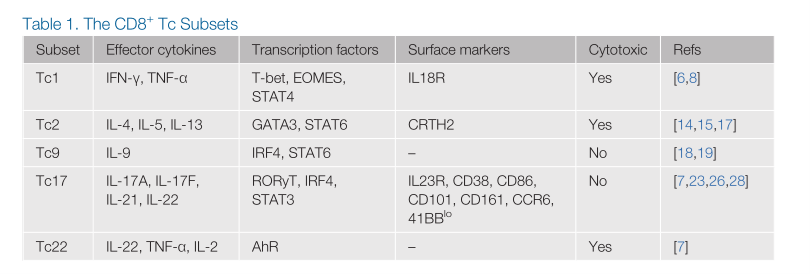
表1.CD8+Tc亚型特征
1.Tc1细胞:一种典型的细胞毒性T细胞
Tc1细胞作为典型的细胞毒性CD8+T细胞,细胞毒性较强,能有效地杀死肿瘤细胞和携带细胞内病原体的细胞。Tc1亚型的产生,通常是由抗原提呈细胞(APC)分泌的IL-12介导的,除此之外,Tc1细胞的分化还由几个关键的转录因子介导的,包括信号转导和转录激活因子(STAT4)、T-bet和EOMES(脱中胚蛋白),共同促进了IFN-γ的产生。Tc1细胞在功能上,会产生高水平的穿孔素、颗粒酶B、IFN-γ和肿瘤坏死因子的特点,但是低表达IL-4、IL-9和IL-17。除了细胞因子外,Tc1细胞还可以通过其细胞表面高表达IL-18R从而和其他Tc亚群区分开来。
2. Tc2细胞
CD8+Tc2细胞是继Tc1之后发现的Tc亚群。Tc2细胞也高表达颗粒酶B,并具有强大的细胞毒性,与Tc1相比IFN-γ的产生量减少。Tc2细胞的极化是由细胞因子IL-4驱动的,IL-4激活转录因子STAT6和GATA3。Tc2亚型也会产生细胞因子,如IL-4、IL-5和IL-13,可以促进IgE的产生和病原细胞的聚集,Tc2在介导过敏反应中发挥着重要作用。
3. Tc9细胞
CD8+Tc9细胞,它们产生IL-9,但产生的IFN-γ较少。Tc9 细胞的极化条件是确定的,由细胞因子 IL-4 和 TGF-β 的联合作用(两者由转录因子 STAT6 和(IRF4) 介导的) ,而与Tc1和Tc2细胞不同,Tc9细胞表现出较差的细胞毒性,部分原因是它们产生的颗粒酶B有限。研究发现,在小肠和哮喘患者的血液中发现了Tc9细胞,它们被认为会促进疾病的发展。
4. Tc17细胞
产生IL-17的CD8+Tc17细胞是T细胞的一个独特亚群,它的特征是会产生大量的IL-17A、IL-17F和IL-22,同时低表达IFN-γ。与Tc9细胞类似,Tc17s也表达低水平的颗粒酶B,并具有较差的细胞溶解功能。Tc17细胞的分化同时也受到细胞因子与转录因子影响,IL-6和TGF-β的结合促进了它的分化,IL-1β、IL-21或IL-23的加入进一步增强了这种分化。IL-6会使转录因子STAT3和RoRγt被激活,这是Tc17分化所必需的条件。值得注意的是,Tc17细胞的几个表面标志物已经在mRNA或蛋白质水平上被鉴定出来,包括IL-23R、CD38、CD86、CD101、CD103和CCR6。相关研究表明,Tc17细胞在稳态条件下和肿瘤微环境(TME)中已在人类皮肤组织中检测到,并被认为对某些真菌病原体具有保护作用。此外,Tc17细胞在自身免疫性疾病的有害作用已被确认,包括多发性硬化症,以及移植物抗宿主病的反应中。除了作为效应细胞外,有证据表明Tc17还可以分化为长寿的记忆T细胞(见补充内容2)。
补充内容1:许多记忆CD8+T细胞来源于Tc1。然而,记忆细胞是否起源于其他Tc亚群尚不清楚。有一些证据表明,Tc17细胞可以分化成一个长期存活的群体,可以持续一年以上。此外,这些记忆Tc17细胞在再次暴露于抗原,会进行大量增殖和产生IL-17。在代谢方面,Tc17细胞表现出最大氧化呼吸量的增加,这是记忆T细胞的典型特征。有趣的是,在一项研究中发现,记忆Tc17细胞并不总是采用中枢记忆表型(Tcm,这些细胞主要位于淋巴组织,并表达淋巴归巢分子CD62L和CCR7)。为了支持这一假设,研究发现,与Tc1细胞相比,Tc17细胞表达更高水平的组织驻留记忆T细胞(TRM,这些细胞位于粘膜层)标记CD103。事实上,在健康患者的皮肤中已经检测到组织驻留的Tc17细胞,并被认为在对抗共生微生物的反应中具有作用。综上所述,这些研究提供了早期证据,表明Tc1细胞以外的亚群可以分化为长期记忆群体。
5.Tc22细胞
Tc22细胞是CD8+T细胞的一个亚群,主要产生IL-22,很少产生其他亚型的细胞因子。已在皮炎和牛皮癣等炎症病变中检测到Tc22,它们被认为有助于疾病病理,以应对包括艾滋病毒在内的病毒感染,并在浸润性鳞状细胞癌中被发现。最近的研究发现,IL-6、TNF-α和AhR(芳烃受体)激动剂是Tc22分化的驱动因素。在功能上,Tc22s表达颗粒酶B,具有高度的细胞杀伤力,并在过继转移研究中提供了特殊的抗肿瘤活性。尽管Tc22s的生物学意义仍不明确,但可以在人类卵巢癌患者中检测到,在肿瘤中扩增的CD8+T细胞中,Tc22可占高达35%。
三、Tc亚群在TME中的作用?
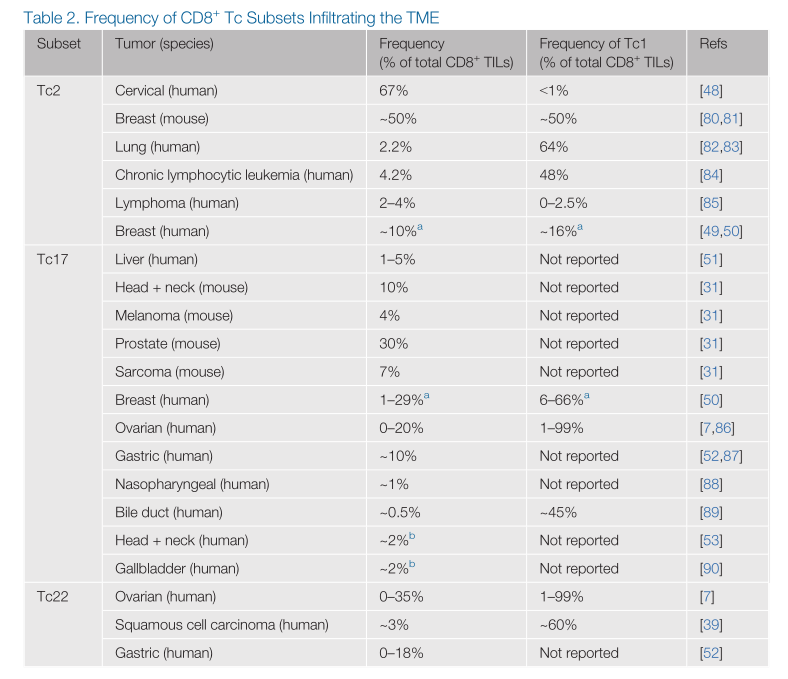
表2.CD8+T细胞亚群渗入TME的频率
1.Tc1
不同类型的细胞在TME中起促进或抑制肿瘤生长的作用。TME中可检测到多种免疫细胞,包括CD8+T细胞及其亚群。已有研究表明,最常见的亚群是经典的Tc1细胞,在分离的人和小鼠肿瘤浸润性淋巴细胞(Til)中检测到这种细胞,包括黑色素瘤、卵巢癌、乳腺癌和肺癌(详见表2)。Tc1的存在往往与更有利的预后相关,这可能是因为它们与IFN-γ一起具有特殊的细胞毒性有关。总结IFN-γ的作用有如下几个方面:(1)在TME中,IFN-γ与激活信号协同作用,会上调APC上的MHC-I,从而增强肿瘤中的抗原呈递和初始T细胞的激活。(2)IFN-γ还可以帮助重新编码TME中的抑制细胞,如调节性T细胞(Treg),使机体对肿瘤细胞产生抗原耐受,会使肿瘤细胞发生免疫逃逸。(3)IFN-γ还直接作用于肿瘤细胞上调MHC-I,从而增加他们对CD8+T细胞依赖的细胞毒性的易感性。事实上,IFN-γ对肿瘤细胞的直接作用对抗肿瘤反应至关重要,研究表明,如果患有黑色素瘤的患者,肿瘤的IFN-γ受体下游的信号分子发生功能丧失,就会对免疫治疗产生抗药性。
2.Tc2
除此之外,在一些患者中,Tc1细胞以外的亚群占CD8+TIL的比例更大(详见表2)。在宫颈癌患者中,浸润性肿瘤的CD8+T细胞中67%是Tc2细胞,而Tc1细胞的比例<1%。在乳腺癌患者中,肿瘤训练淋巴结(TDLN)中的Tc2/Tc1比率与肿瘤大小无关,它可能与分期有关,因为III期乳腺癌患者的TDLN中Tc2细胞的数量几乎是II期癌症患者的两倍,而Tc1细胞的百分比保持不变。鉴于肿瘤分期与患者生存呈负相关,Tc2细胞也可能与乳腺癌患者的生存呈负相关,这种可能性有待进一步研究。
3.Tc17
多项研究还在一些小鼠和人类肿瘤中检测到Tc17s,如肝细胞癌、黑色素瘤、前列腺癌和胃癌。在一项研究中,与I期和II期相比,III和IV期胃癌患者TIL中Tc17的数量显著增加。重要的是,TIL中Tc17s含量高的患者与Tc17s含量低的患者相比,总体存活率显著下降。尽管这背后的机制尚不清楚,但这种不良的预后可能部分是由IL-17介导的。IL-17可以直接作用于TME内的肿瘤细胞或其他类型的细胞,以促进抑制和血管生成因子的产生,如血管内皮生长因子(VEGF),以及促进具有促肿瘤作用的细胞类型的招募,包括中性粒细胞和髓系来源的抑制细胞(MDSCs)。有关研究已表明,IL-17水平升高与包括肝细胞癌和肺癌在内的多种癌症的总体生存率较低有关。有趣的是,在某些情况下,例如食道癌,它也可以是一个积极的预后因素。因此,尽管目前的发现表明肿瘤中的Tc17细胞控制肿瘤生长的能力有限,但可能有一小部分肿瘤中Tc17和IL-17的产生是有益的。
4.Tc9和Tc22
关于TME内Tc9和TC22细胞的存在和意义的信息较少。在胃癌患者和与移植相关的鳞状细胞癌患者中也发现了Tc22细胞。最近,Tc22s在大约30%的卵巢癌患者中也发现了它们,在扩增的CD8+TIL中,它们的比例高达35%,在一些患者中,它们的数量超过了Tc1或Tc17亚群。产生IL-22的CD8+T细胞数量增加的患者无复发生存期显著延长,这表明这些细胞在卵巢癌中具有潜在的预后意义。总而言之,这项研究和其他研究清楚地表明,TME中可以发现Tc1细胞以外的亚群,并在抗肿瘤反应和预后中发挥作用。
四、TME在Tc极化中的作用?
目前尚不清楚在TME内检测到的Tc亚群是在其他地方极化并被招募到TME中,还是在进入TME时由于这种环境中存在的因素而极化。作者通过几个研究结果表明,第二种假设可能是正确的,(1)在TME内可以出现三级淋巴结构,活跃地招募和激活初始T细胞。一旦进入肿瘤,初始T细胞可以受到TME中高水平的细胞因子的影响,如TGF-β,可以促进对Tc9和Tc17分化。(2)一项研究发现,从人肝细胞癌肿瘤中分离的巨噬细胞,而不是从非肿瘤组织中分离出来的巨噬细胞,在没有外源性极化细胞因子的情况下,在体外与CD8+T细胞培养时,可以产生Tc17细胞。但是,对于Tc1细胞,却有相互矛盾的结果,因为从TME中分离出的APC既可以促进Tc1分化,也可以抑制Tc1分化和IFN-γ的产生。APC细胞是否可以诱导TME内的其他TC亚群也不清楚。值得关注的是,当暴露于TME内的因素时,也可能将现有的Tc亚型从一个亚型转换为另一个亚型。例如,在Tc9和Tc17细胞中已经证明了可塑性,因为它们在转移到荷瘤小鼠后可以转换为Tc1表型。综上所述,很明显,TME在形成CD8+T细胞反应中的重要性开始被揭示;然而,未来的研究应该着眼于更好地了解所涉及的机制和这些亚群对抗肿瘤反应的影响。
五、Tc亚群与过继免疫治疗
过继免疫治疗是利用免疫系统的力量来治疗癌症是一种很有前途的治疗方法。在这当中转移肿瘤特异性T细胞较为有效,包括T细胞受体修饰的T细胞(TCR-T)、嵌合抗原受体修饰的T细胞(CAR-T),肿瘤浸润性淋巴细胞(TIL)。这些治疗的核心是在过继转移之前在体外激活和扩增肿瘤特异性T细胞。所以将CD8+T细胞极化成具有强大抗肿瘤特性的Tc亚型是能够增强这一作用的重点任务。在确定更新的亚型之前,Tc1细胞的作用是重中之重的,因为在多个小鼠过继转移肿瘤模型中,它们的表现一直优于Tc2细胞。
有趣的是,在体外,Tc1和Tc2细胞却具有相似程度的细胞毒性,Tc2在体内与体外有如此区别很可能还有其他因素导致Tc2的表现减弱,例如它们产生IL-4。IL-4可以作为一种促进T细胞增殖的生长因子,但IL-4已被证明具有促肿瘤作用,这可能会抑制Tc2介导的反应。除此之外,IL-4有促进巨噬细胞向M2表型转化的作用,会使巨噬细胞分泌抑制T细胞功能的抗炎分子。
对于Tc17在过继性免疫治疗中的作用,也是有相关的研究报道的。研究表明,转移到B16荷瘤小鼠的Tc17细胞可以抑制肿瘤生长,这种依赖Tc17的免疫被证明部分依赖于它们产生IFN-γ的能力。这表明Tc17细胞表现出一定程度的可塑性,体外极化的Tc17细胞可以转变为Tc1表型(见补充内容2)。此外,Tc17的抗肿瘤作用治疗成功取决于所使用的模型。例如,将Tc17细胞过继转移到已建立肿瘤的小鼠体内后,观察到最小的抗肿瘤活性。然而,当Tc17细胞与淋巴去除、肿瘤抗原疫苗接种和/或体内支持性IL-2治疗一起使用时,注意到了强大的抗肿瘤效果。
对于Tc9在过继性免疫治疗中的作用于Tc17是比较类似的。最近的发现,仅极化的Tc9细胞在治疗公认的B16肿瘤方面显示出较差的抗肿瘤功能。然而,当Tc9与体内支持性治疗(IL-2注射、肿瘤抗原疫苗+/-淋巴去除)一起使用时,Tc9在治疗公认的黑色素瘤方面显示出特殊的效果。因此它们在遇到这些支持性治疗后可以持续并经历强劲的增殖爆发,但本身缺乏令人满意的抗肿瘤功能。
补充内容2:多个实例中观察到CD8+T细胞亚群具有可塑性。在过继转移到荷瘤小鼠后,体外极化的Tc17细胞和Tc9细胞转变为Tc1表型。此外,一项研究发现,过继转移的Tc17细胞在TDLN中保留了Tc17表型,尽管在浸润性肿瘤的Tc17细胞中观察到了一定程度的Tc1表型可塑性。这些研究表明,TC谱系具有保持稳定的潜力,但体内信号有助于向另一种TC谱系的转化,如Tc1。未来的研究应该致力于确定这些因素,以便更好地理解维持对TC血统的承诺的机制。
影响其抗肿瘤效应的另一个方面是其代谢状态。研究表明Tc22细胞表现出强大的抗肿瘤特性,在B16黑色素瘤模型中表现至少与Tc1细胞一样。从机制上讲,相对于Tc1或Tc17细胞,Tc22细胞中线粒体蛋白和ATP的含量增加,这表明每个亚群之间存在潜在的代谢差异。除了Tc22细胞外,据报道,Tc9细胞中的胆固醇代谢也影响其抗肿瘤活性。综上所述,很明显,在免疫治疗的背景下,每个亚群都有与其谱系相关的不同的功能和代谢特性,在设计未来的免疫治疗方法时应考虑到这一点。
第三部分 总结
CD8+T细胞不仅具有杀伤细胞的能力和产生IFN-γ的能力,而且将CD8+T细胞简单地称为细胞毒性T细胞是一个错误的措辞。目前已经鉴定出多个CD8+T细胞亚群,每个亚群都具有不同的效应功能。这些亚群已经在TME中被检测到,在许多情况下,它们的生物学意义在很大程度上是未知的。很明显,即使对于相同的癌症类型,不同的患者之间在TME内每个Tc亚群的相对频率也有很大的差异。这种TC亚群的组成很可能不仅会影响预后和存活率,还会影响针对免疫系统的新疗法的应答率。还需要进一步的研究来了解这些亚群在抗肿瘤反应中的确切功能,以及TME内可能影响其分化的因素。然后,可以开发新的治疗策略,选择性地靶向特定的TC亚群,以提高癌症的治疗和预后。
文章来源: https://doi.org/10.1016/j.tcb.2020.06.003
LabEx多因子实验服务专家
LabEx 紧跟全球蛋白检测技术前进步伐,与多个前沿平台紧密合作,不断发掘蛋白质定量检测技术的灵敏度和多重分析检测极限,始终致力于为您的研究需要,提供最好的免疫分析技术与产品。现有全面包含蛋白、基因、细胞、组织水平的 PCR Array、ELISA、MSD、Luminex、CBA、抗体芯片、流式、免疫组化等多个技术平台。通过线下和线上的方式为超过2000家客户提供服务,年检测样本超25万!

常用的各类细胞主要分泌因子图
★ 检测样本:血清、血浆、眼泪、房水、唾液、体腔灌洗液、细胞培养液上清、细胞裂解物等等各种液相样本中可溶性细胞因子、炎症因子、趋化因子、酶等的浓度检测
★ 肿瘤研究及肿瘤疾病的辅助诊断、疗效和预后监测
★ 干细胞研究和干细胞治疗监测
★ 免疫学研究和免疫疾病的辅助诊断和监控
★ 感染疾病的研究及辅助诊断和疗效评价
★ 免疫功能监测
★ 药效评价,药物研发、疫苗研究
★ 细胞信号传导中磷酸化蛋白、凋亡相关蛋白定量分析
LabEx为您提供完整的实验结果报告,包括数据分析结果,原始数据文件,实验protocol等。













 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


