冠状病毒病2019 (COVID-19)是由冠状病毒科的一种新成员——严重急性呼吸综合征冠状病毒2 (SARS-CoV-2)引起的。COVID-19对全球公共卫生构成重大威胁。因为它具有高度传染性和严重的临床后果,控制大流行的主要策略之一是开发有效的疫苗,本研究检测SARS-CoV-2灭活疫苗的安全性和免疫原性。将从以下4个方面阐释。

1. 研究对象的纳排标准及分组情况(图1)、人口学特征(表1)
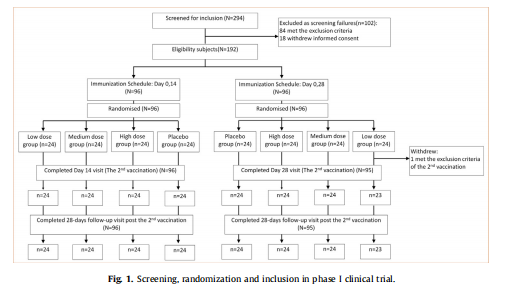
图1一期临床试验的筛选、随机化和纳入

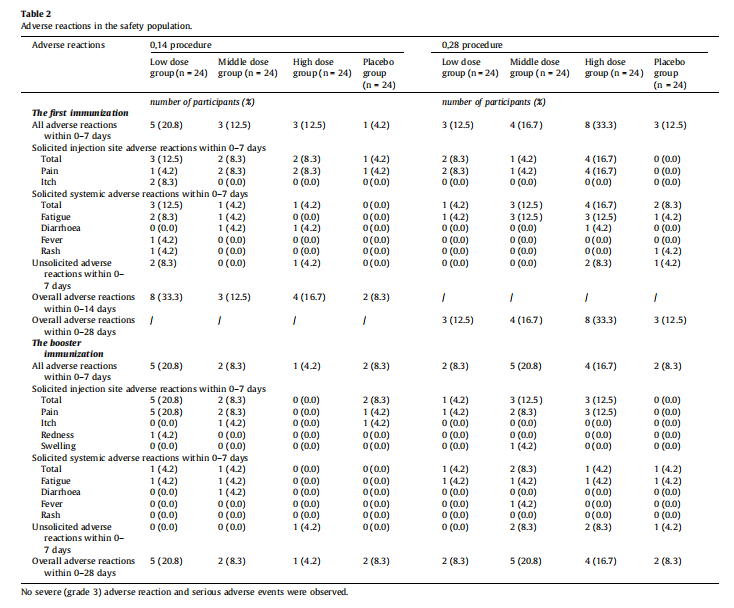
2、不良反应综合观察
最常见的不良反应为注射部位轻微疼痛、发红及轻微疲劳(表2)。
此外,与安慰剂组的血清相比,按2种方案接种的3个剂量组的免疫受试者血清中的各种细胞因子水平没有显示出异常(图2)。
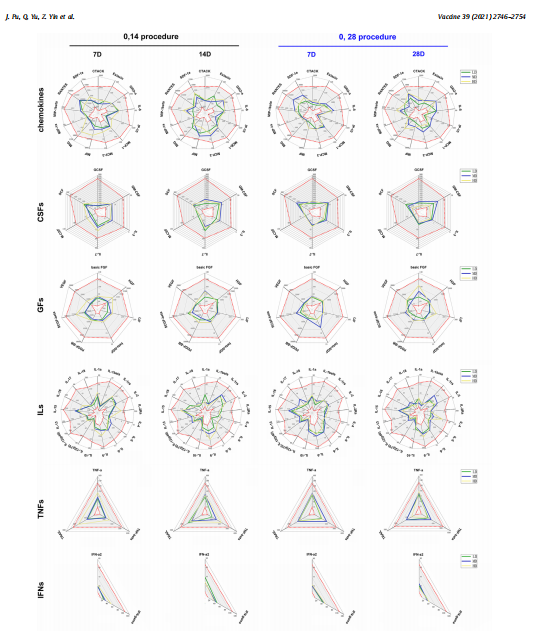
图2受试者血清中的各种细胞因子水平表达(使用Bio-Plex Pro Human Cytokine 48- plex (BioRad, Hercules, California, USA))
在外周血中各种T细胞数量方面,疫苗组和安慰剂组之间没有显著差异(图3)。
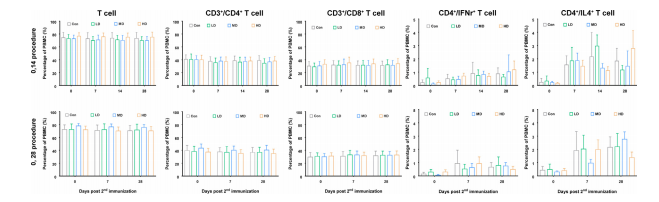
图3灭活疫苗免疫个体外周血中的T细胞群
这些结果表明,与疫苗接种相关的细胞因子水平和免疫细胞数量变化相关的免疫病理事件没有发生。
3、评估3个剂量组对2种方案的免疫效果
分配到两种方案的三个剂量组的结果表明,与安慰剂组相比,分配到0、14方案的组中免疫受试者的中和抗体滴度在增强剂后第7天,低、中、高剂量组的血清转换率为54.2%、100%和87.5%,以及它们的几何平均滴度(GMTs)分别增加了5.2、45.1和27.4。在第14天,三组血清转化率达到87.5%、100%、95.8%,GMTs分别为18.1、54.5、37.1(图4a)。然而,中和抗体滴度在第14天至第28天呈下降趋势。加强免疫后第7天开始,中和抗体呈上升趋势,血清转归率为54.2%(低剂量)、79.2%(中剂量)和69.6%(高剂量),GMTs分别为4.2、11.2和8.9(图4b)。
值得注意的是,不管参与者被分配到哪个时间表,含有S蛋白、N蛋白和病毒粒子抗体的ELISA基本上同步增加(图4a, b)。特异性阳性细胞毒性T淋巴细胞(CTL)对S蛋白的反应,elisa检测的N蛋白和病毒粒子显示,两种方案的增强剂在28天后均显著增加(图4a, b)。
这些结果表明,疫苗引起了涉及抗体和CTL对病毒抗原的同步动态反应。此外,研究发现免疫血清能中和北美的大流行毒株(图4c)。
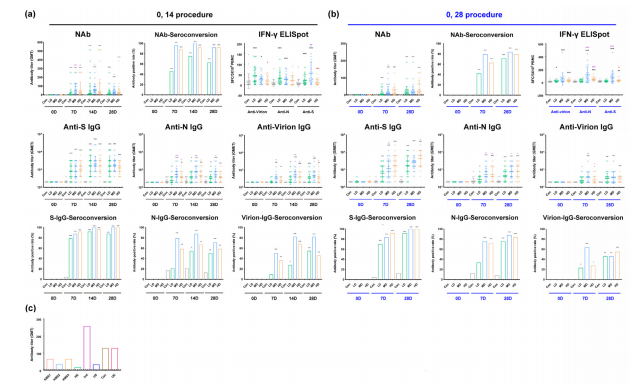
图4接种SARS-Cov-2灭活疫苗后,可诱导人产生免疫应答
为了研究疫苗的免疫原性,我们在加强免疫后的第7天和第28天,对两种方案中剂量组免疫个体的PBMCs mRNA谱进行了比较分析,以确定疫苗引起的免疫反应的遗传多样性(图5)。结果表明,疫苗在免疫细胞中启动和促进一系列转录活动,导致许多与免疫应答相关的基因显著上调。将所有上调基因分类为各种免疫功能表明,与安慰剂对照相比,使用两种方案接种中剂量的疫苗可导致先天性和适应性免疫反应的特异性激活。

图5 SARS-Cov-2灭活疫苗免疫应答相关基因的遗传多样性
4、讨论
根据受试者的临床安全观察结果显示,未发生与疫苗接种相关的严重不良反应,报道最多的事件为轻度事件,包括接种部位红肿、瘙痒和少量轻度疲劳,接种疫苗组和对照组之间没有显著差异。这些数据支持该疫苗的临床安全性。该研究的一个局限性是缺乏对疫苗保护效果的分析,以及缺乏对接种疫苗者和COVID-19患者PBMCs的比较转录分析。
文章中用到Bio-Plex Pro™ 人细胞因子48-Plex筛选试剂盒及Luminex技术。该Bio-Plex Pro™ 试剂盒是针对科研和新药开发的高性能多重筛选试剂盒细胞因子和趋化因子是一类重要的胞外信号介质,调控细胞间信号网络并在炎症、急/慢性疾病中发挥重要作用。该筛选试剂盒将参与调控网络相关的细胞因子和趋化因子整合至同一试剂盒,可一次实验同时筛选多达48个靶标。该试剂盒提供了全面稳定的解决方案,可在同一个孔内同时对48个相关靶标完成筛选,加速突破性的研究和新药发现。该试剂盒中所有检测均经过严格验证,确保所得数据稳定、可靠。
Bio-Plex Pro™液相芯片(luminex)技术
Bio-Plex Pro™ 试剂盒系列产品采用基于独特微磁珠“染色”的液相芯片技术,不同“颜色”微珠偶联单克隆抗体与待检测蛋白,偶联生物素-链霉亲和素-荧光的检测抗体共同形成了”三明治”夹心复合物,只需要 10µl 的样品就能够实现对上百种细胞因子同时检测。
Bio-Plex多重蛋白液相芯片技术特点:
* 小样本:仅需10µl
* 大数据:同时检测多达几十种指标
* 检测灵敏度:0.04pg/ml
* 快速:仅需2-3个小时
* 物种:人、小鼠、大鼠、犬
* 研究领域覆盖:细胞因子、肿瘤、趋化因子、自身免疫性疾病、代谢等。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


