白介素-18(IL18,也称为干扰素-γ诱导因子)是一种蛋白,其在人中由编码IL18 基因。该基因编码的蛋白质是促炎细胞因子。造血细胞和非造血细胞等许多细胞类型都有产生IL-18的潜力。白介素-18(IL18,也称为干扰素-γ诱导因子)是一种蛋白,其在人中由编码IL18 基因。该基因编码的蛋白质是促炎细胞因子。造血细胞和非造血细胞等许多细胞类型都有产生IL-18的潜力。
1989年首次将其描述为诱导小鼠脾细胞中干扰素-γ(IFN-γ)产生的因子。最初,库普弗细胞可识别IL-18的产生,肝脏常驻巨噬细胞。然而,IL-18在非造血细胞,例如肠上皮细胞,角质形成细胞和内皮细胞中组成性表达。IL-18可以调节两个先天和适应性免疫和其调节异常可能会导致自身免疫或炎症性疾病。
一、IL-18受体和IL-18信号传导
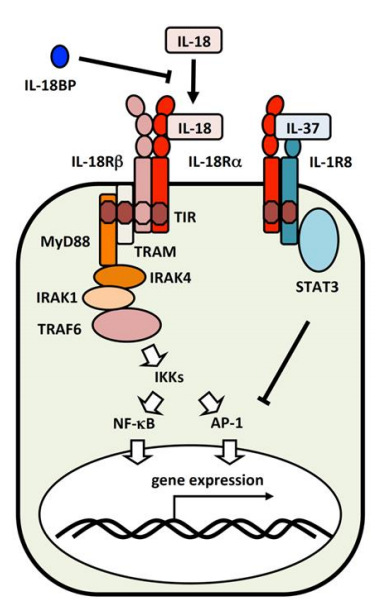
IL-18 受体由可诱导成分IL-18Rα 组成,该成分以低亲和力结合成熟的IL-18 和组成型表达的 共受体 IL-18Rβ。IL-18与配体受体IL-18Rα 结合,诱导IL-18Rβ募集形成高亲和力复合物,该复合物通过toll / interleukin-1受体(TIR)域发出信号。该信号结构域可激活激活促炎程序和NF-κB途径的MyD88 衔接蛋白。IL-18的活性可以被结合的细胞外白介素18结合蛋白(IL-18BP)抑制可溶性 IL-18的亲和力高于IL-18Rα,因此可防止IL-18与IL-18受体结合。IL-37是另一个抑制IL-18作用的内源性因子。IL-37 与IL-18 具有高度同源性,可以与IL-18Rα结合,然后与IL-18BP形成复合物,从而降低IL-18的活性。此外,IL-37与单一免疫球蛋白IL-1受体相关蛋白(SIGIRR)结合,也称为IL-1R8或TIR8,与IL-18Rα形成复合物并诱导抗炎反应。IL-37 /IL-18Rα/ IL-1R8复合物激活STAT3信号通路,降低NF-κB和AP-1激活并减少IFNγ的产生。因此,IL-37和IL-18具有相反的作用,IL-37可以调节IL-18的促炎作用。
IL-18信号转导
当IL-18与IL-18Rα结合时(黑色箭头),IL-18Rβ与复合物结合。IL-18信号通过包括MyD88,IRAK和TRAF6在内的信号转导分子激活转录因子NF-κB和AP-1(白色箭头)。IL-18BP与IL-18竞争与IL-18Rα的结合。当IL-18Rα与IL-37结合时,它阻止与IL-18Rβ的结合,后者与IL-1R8结合以通过STAT3发送抑制信号。
二、IL-18功能
IL-18属于IL-1超家族,主要由巨噬细胞产生,但也由其他细胞类型产生,刺激各种细胞类型并具有多效性功能。IL-18是促发1型反应的促炎细胞因子。它与IL-12一起,在被诸如脂多糖(LPS)的微生物产物感染后诱导细胞介导的免疫。IL-18与IL12联合作用于CD4,CD8 T细胞和NK细胞以诱导IFNγ产生,II型干扰素在激活巨噬细胞或其他细胞中起重要作用。已证明此IL-18和IL-12的组合可抑制IL-4依赖性IgE和IgG1的产生并增强B细胞中 IgG2a的产生。重要的是,在没有IL-12或IL-15的情况下,IL-18不会诱导IFNγ的产生,但在将幼稚T细胞分化为Th2细胞并刺激肥大细胞和嗜碱性粒细胞产生IL-4时发挥重要作用,IL-13和化学介质,例如组胺。
1、IL-18对于肠内稳态的重要性
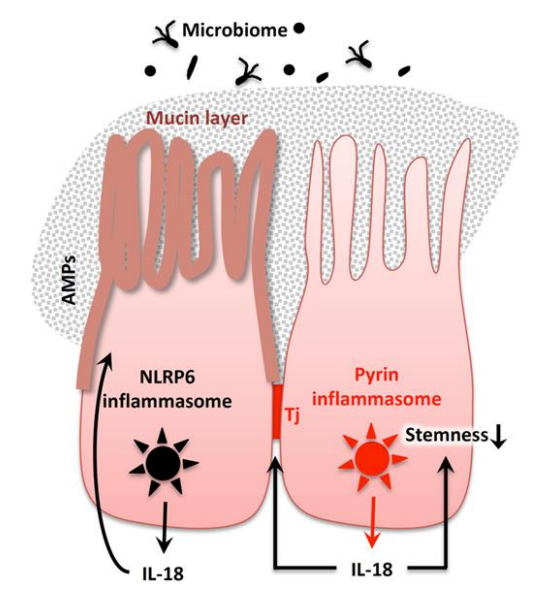
肠上皮细胞利用各种炎症小体来组成型生产IL-18。在SPF条件下,结肠上皮细胞释放依赖于NLRP6炎性小体的IL-18,IL-18进而激活上皮细胞以产生抗菌肽(AMPs)来维持微生物组稳态。Nlrp6-/-小鼠自发地发生营养不良,导致结肠炎。NLRP6炎性小体通过肠上皮细胞参与稳态粘蛋白层的产生。通过产生完整的紧密连接(Tj),源自吡啶炎症小体激活的IL-18参与肠道稳态。此外,通过炎症反应介导的IL-18通过减少结肠上皮的茎干来预防结肠炎相关的大肠癌。
2、IL-18预防癌症
(A)具杀伤力的人γδT细胞的强劲增殖。IL-18与IL-2结合并激活并诱导人CD56 + CD11c +前体NK细胞的增殖,进而强烈增殖并活化由产生的γδT细胞抗原刺激的γδT细胞。唑来膦酸(Zol)处理的单核细胞(Mo)。
(B)在结肠癌的诱导中涉及CLRs介导的CARD9炎性小体活化。肠道微生物菌群中的真菌通过C型凝集素受体(CLR)激活巨噬细胞,后者通过SARD9炎性小体促进Syk激活caspase-1。产生的IL-18是保护结肠炎和与结肠炎相关的癌症所必需的。
3、白介素(IL)-18促进Th1反应和Th2反应
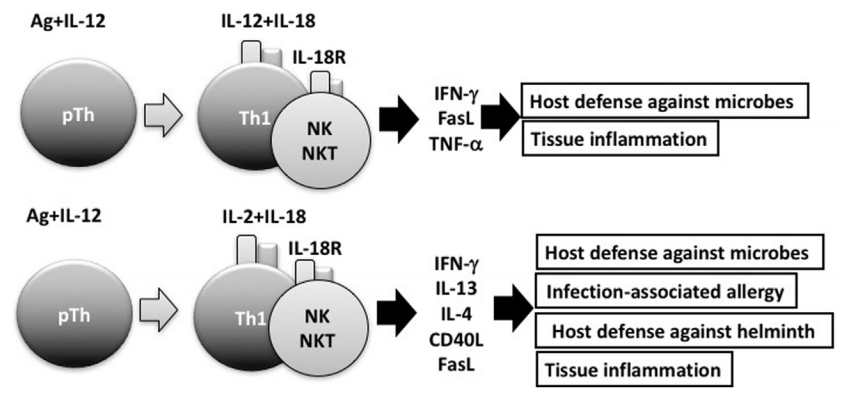
IL-18与IL-12结合可刺激Th1细胞,自然杀伤(NK)细胞和NKT细胞产生强大的干扰素(IFN)-γ,从而清除细胞内微生物。但是,没有IL-12但有IL-2,IL-18诱导Th1细胞,NK细胞和NKT细胞产生IL-13和IFN-γ,这两者均参与宿主防御反应或感染相关的过敏反应 。IL-2和IL-18刺激的NKT细胞表达CD40L并产生IL-4,从而诱导B细胞产生IgE。
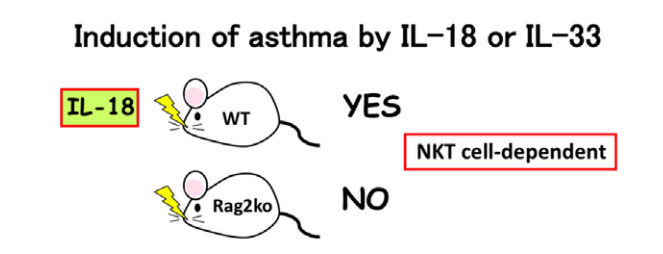
4、通过鼻内给予白介素(IL)-18或IL-33诱导支气管哮喘
由于天然杀伤(NK)T细胞组成型表达IL-18R,因此将IL-18鼻内给药至野生型小鼠中,但不向Rag2Ko小鼠鼻内给药,通过诱导NKT细胞中的IL-4和IL-13诱导支气管哮喘。
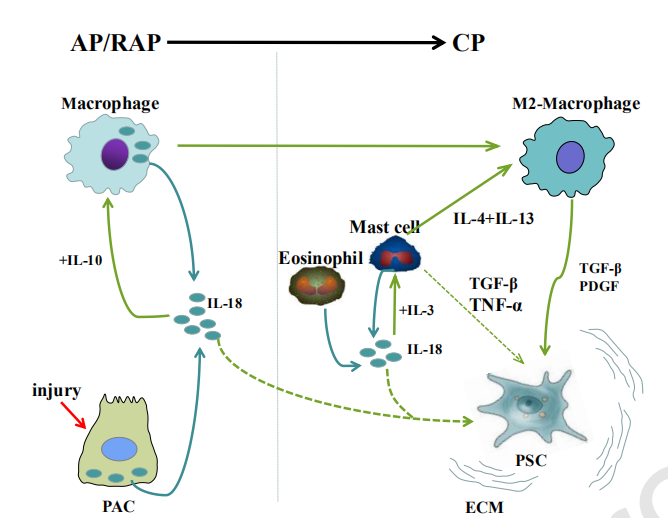
5、IL-18可能与AP/RAP向CP的发展有关
当发生AP/RAP时,受伤的PAC和巨噬细胞可在胰腺局部产生IL-18。一方面,在与IL-10共同刺激下,局部IL-18可以诱导M2巨噬细胞极化,M2巨噬细胞是渗透到CP胰腺组织中的主要巨噬细胞类型。这些细胞进一步产生TGF-β和PDGF-β,以激活诱导胰腺纤维化的PSC。另一方面,细胞外IL-18可能直接激活PSC,但该事件尚未得到证实,需要进一步研究。此外,浸润的嗜酸性粒细胞和肥大细胞也可能是CP胰腺组织微环境中IL-18的潜在来源。此外,与IL-3协同作用,IL-18可以促进肥大细胞的活化,从而产生IL-4和IL-13,从而进一步增加M2巨噬细胞的数量。此外,还显示活化的肥大细胞通过产生TGF-β和TNF-α诱导PSC的活化。
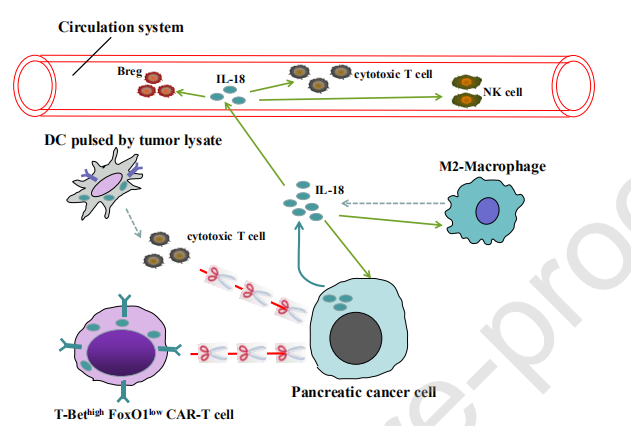
6、IL-18对PDAC细胞的多种作用
PDAC细胞是通过PDAC在局部胰腺组织中积累的IL-18的明确来源。根据现有证据,IL-18对PDAC细胞具有多种作用:(i)通过激活NF-κB途径促进PDAC细胞增殖,迁移和侵袭的直接作用,以及(ii)间接的抗肿瘤作用通过增加循环系统中细胞毒性T和NK细胞的种群。此外,循环中的IL-18还被证明可以通过激活Breg来诱导免疫抑制。此外,PDAC裂解物脉冲的DCs疫苗中IL-18的上调增强了其对PDAC的治疗功效,这可能与T细胞和NK细胞的细胞毒性增加有关。类似地,CAR-T细胞中IL-18的过表达通过下调FOX1抑制PD-1的表达并因此减少CAR-T细胞的衰竭而提高了其抗肿瘤活性。此外,IL-18可能参与了M2巨噬细胞的极化,M2巨噬细胞是微环境中主要的免疫抑制细胞。
三、IL-18与疾病
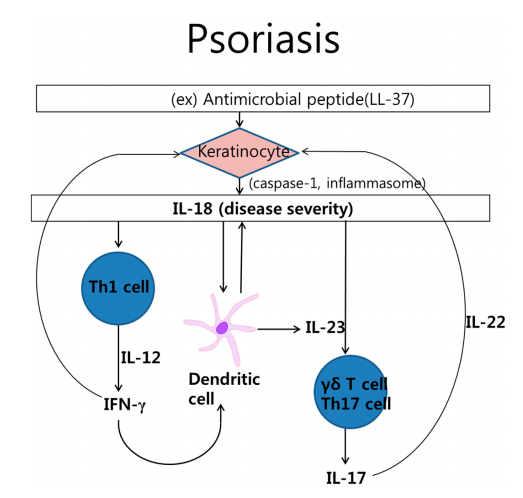
1、银屑病发病机理中的白介素(IL)-18
细胞因子和细胞之间复杂的相互作用涉及牛皮癣的病理过程。由cathelicidin LL-37刺激的角质形成细胞产生IL-18。IL-18激活Th1细胞,产生干扰素-γ(IFN-γ)。IL-18还刺激分泌IL-17的Th17细胞或γδT细胞。另外,树突状细胞产生IL-18和IL-23。
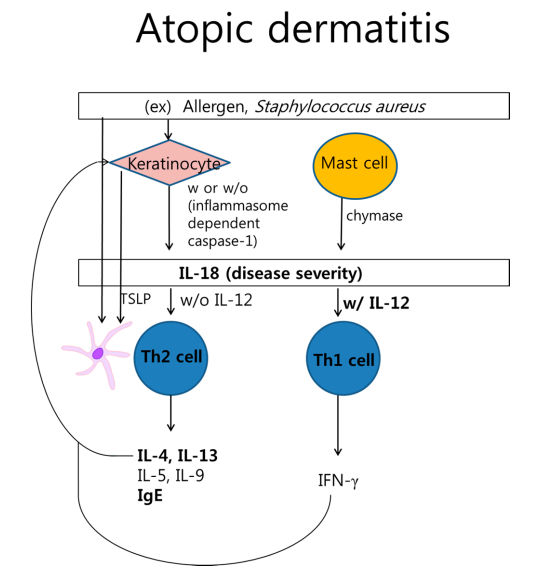
2、白细胞介素(IL)-18在特应性皮炎的发病机理中
角质形成细胞或肥大细胞通过蛋白水解过程发挥IL-18活化作用。IL-18可基于IL-12诱导Th2或Th1细胞因子。来自角质形成细胞的变应原或胸腺基质淋巴细胞生成素(TSLP)激活的树突状细胞与Th2细胞相互作用。
3、在CLE中,凋亡的角质形成细胞主要存在于表皮的基底层
在角质形成细胞上高IL-18R表达的IL-18敏感性改变似乎是CLE的特征。IL-18 在皮肤病损的表皮中表达–诱导趋化因子CXCL10的表皮生成,有利于吸引产生IFNγ的淋巴细胞。T细胞在角质形成细胞附近的真皮表皮边界附近积聚。此外,IL-18导致TNFα从活化的角质形成细胞释放。TNFα在自分泌反馈回路中起作用,以诱导邻近表皮细胞的凋亡。由于狼疮条件下的清除不足,凋亡细胞不会被清除,不会发生“继发性坏死”,结果可能会将危险的分子模式(DAMP)(例如HMGB1或HSP)释放到细胞外空间。当具有免疫能力的细胞在DAMPs的情况下遇到(以前是细胞内自身)抗原时,它们可能会从耐受性(通常由凋亡细胞诱导)转变为自身免疫应答/或细胞毒性,如果不存在,这种情况也可能会有利CLE皮肤病变中Treg细胞的表达。DAMPs还可有助于进一步激活角质形成细胞表达趋化因子和细胞因子,从而维持局部炎症。IL-18对DC的趋化活性也可能有助于上皮真皮浆样树突状细胞(pDC)的积累。已在CLE中发现了pDC ,并且是已知的I型IFN产生者,它们依次激活角质形成细胞,使其在其表面表达IL-18R 。由于炎性介质的存在,破坏了基底膜的完整性,促进了炎性细胞的流入。
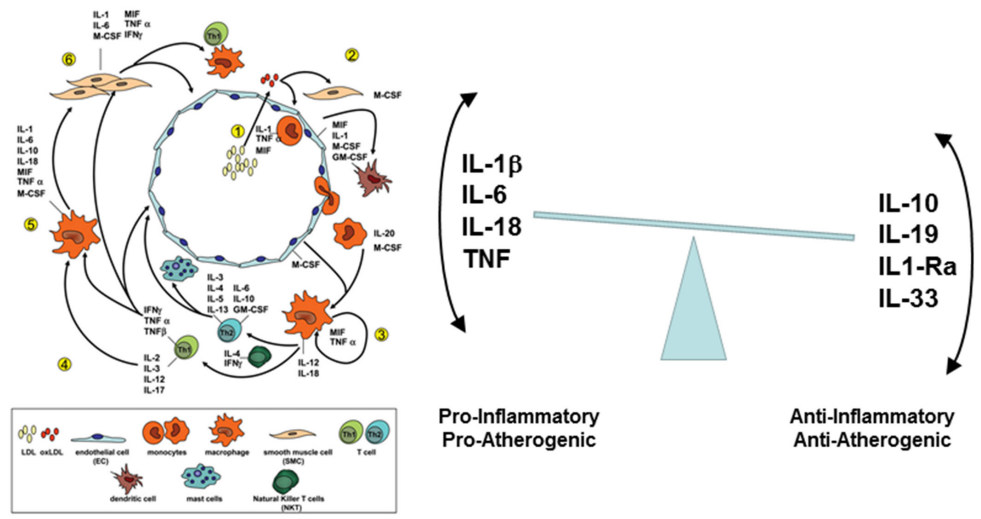
4、与动脉粥样硬化过程有关的细胞因子
来自小鼠研究(左)和人体研究(右)的数据表明,动脉粥样硬化病变的发生过程中促炎和抗炎细胞因子信号通路之间的复杂平衡,以及导致临床事件(例如心肌梗死)的斑块破裂的可能性,卒中和心血管死亡。
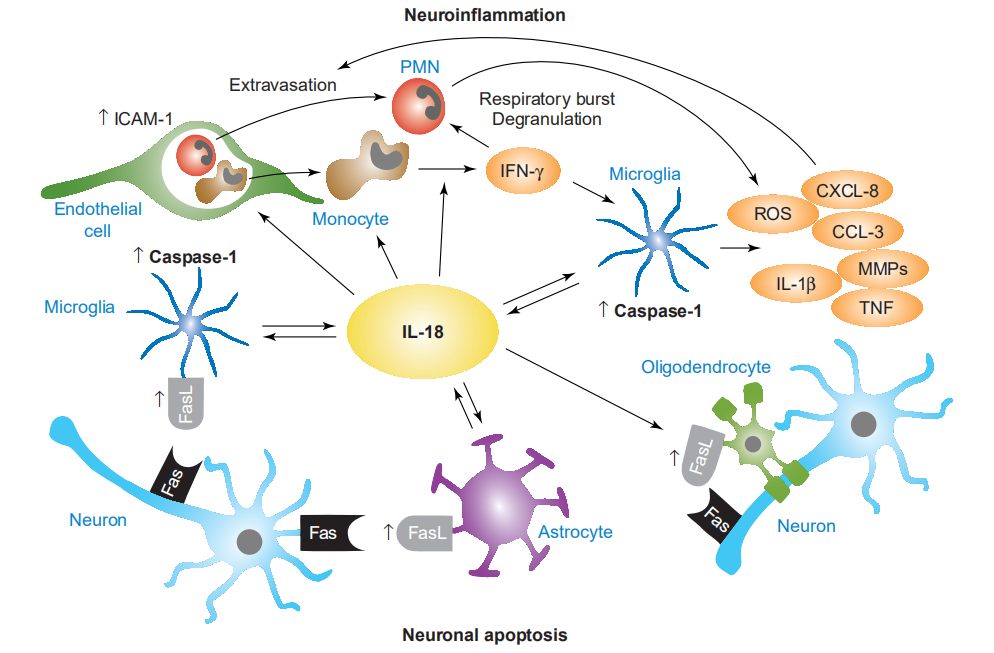
5、IL-18在介导神经炎症和神经变性中起双重作用的假设
小胶质细胞是IL-18的主要来源,它以自分泌和旁分泌的方式(称为IL-18正向环)增强小胶质细胞caspase-1的表达。此外,IL-18诱导小胶质细胞产生基质金属蛋白酶(MMP)和其他促炎性细胞因子,例如TNF和IL-1b。多形核白细胞(PMN)和单核细胞/巨噬细胞的溢出通过内皮细胞上IL-18依赖的细胞间黏附分子-1(ICAM-1)的上调以及CXC和CC家族趋化因子的小胶质细胞生成而被放大,例如CXCL-8(IL-8)和CCL-3(MIP-1a)。IL-18引起PMN的呼吸爆发和脱粒,从而导致神经毒性酶的局部释放。单核细胞分泌的IFN-g刺激后,小胶质细胞和PMN释放出活性氧(ROS),这进一步促进了神经炎症和细胞毒性。另外,小胶质细胞,少突胶质细胞和星形胶质细胞表达由IL-18诱导的FasL,从而增加了炎症条件下Fas介导的神经元凋亡细胞死亡的发生率。
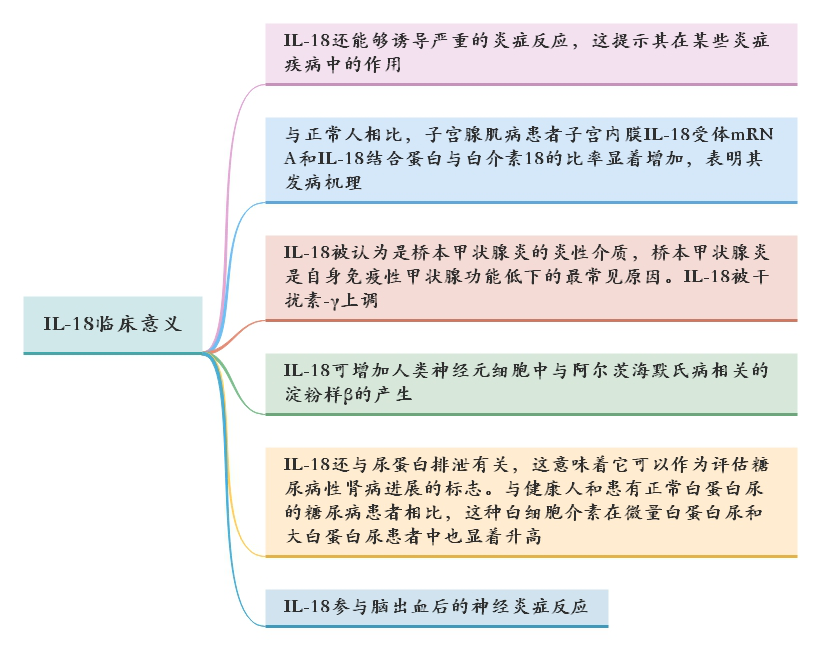
四、IL-18的临床意义
Reference:
[1].Interleukin-18 in Health and Disease.
[2].Unique Action of interleukin-18 on T Cells and Other immune Cells.
[3].IL-18 and Cutaneous Inflammatory Diseases.
[4].Anticytokine Agents Targeting Interleukin Signaling Pathways for the Treatment of Atherothrombosis.
[5].IL-18 and skin inflammation.
[6].The role of interleukin-18 in pancreatitis and pancreatic cancer.
[7].IL-1β/IL-6/CRP and IL-18/ferritin: Distinct Inflammatory Programs in Infections.
[8].Hepatorenal syndrome.
[9].IL-18: a key player in neuroinflammation and neurodegeneration?
研究指标推荐:更多信息,请联系我们~
| 种属 | 检测技术 | 检测方向 | 因子数 | 检测因子 |
| Human | MSD | Viral Infection | 4 | IL-1β, IL-6, IL-8, TNF-α |
| Human | MSD | Viral Infection | 7 | IFN-γ, IL-1β, IL-4, IL-6, IL-8, IL-10, TNF-α |
| Human | MSD | Viral Infection | 9 | IFN-γ, IL-1β, IL-4, IL-5, IL-6, IL-8, IL-10, IL-12p70, TNF-α |
| Human | Luminex | Sepsis | 6 | sFAS / TNFRSF6,sFasL,sICAM-1,MIF,PAI-1 (total),sVCAM-1 |
| Human | Luminex | Sepsis | 7 | Granzyme B,HSP70,IL-1α,IL-8/CXCL8,MIP-1α/CCL3,MIP-1β/CCL4,MMP-8 |
| Human | Luminex | Sepsis | 5 | Lactotransferrin (LTF),Neutrophil Elastase-2(ELA2),NGAL/Lipocalin-2,Resistin,Thrombospondin-1(TSP-1) |
| Human | Luminex | Cytokine | 48 | FGF-basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-1α, IL-2Rα, IL-3, IL-12(p40), IL-16, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, GRO-α, HGF, IFN-α2, LIF, MCP-3, IL-10, IL-12(p70), IL-13, IL-15, IL-17, IP-10, MCP-1(MCAF), MIG, β-NGF, SCF, SCGF-β, SDF-1α, MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF, CTACK, MIF, TRAIL, IL-18, M-CSF, TNF-β |
| Human | Luminex | Chemokine | 40 | 6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GM-CSF,Gro-α /CXCL1,Gro-β/CXCL2,I-309/CCL1,IFN-I,IL-18,IL-2,IL-4,IL-6,IL-8/CXCL 8,IL-10,IL-16,IP-10/CXCL 10,I-TAC /CXCL11,MCP-1 /CCL2,MCP-2 /CCL8,MCP-3 /CCL7,MCP-4 /CCL13,MDC/CCL 22,MIF,MIG/CXCL19,MIP-1α/CCL3,MIP-1δ/CCL15,MIP-3a/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SCYB16/CXCL 16,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25,TNF-α |
| Human | Luminex | Cytokine | 27 | FGF basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12(p70), IL-13, IL-15, IL-17, IP-10, MCP-1(MCAF), MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF |
| Mouse | Luminex | Chemokine | 31 | BCA-1/CXCL13, CTACK/CCL27, ENA-78/CXCL5, Eotaxin/CCL11, Eotaxin-2/CCL24, Fractalkine/CX3CL1, GM-CSF, I-309/CCL1, IFN-γ, IL-1β, IL-2, IL-4, IL-6, IL-10, IL-16, IP-10/CXCL10, I-TAC/CXCL11, KC/CXCL1, MCP-1/CCL2, MCP-3/CCL7, MCP-5/CCL12, MDC/CCL22, MIP-1α/CCL3, MIP-1β/CCL4, MIP-3α/CCL20, MIP-3β/CCL19, RANTES/CCL5, SCYB16/CXCL16, SDF-1α/CXCL12, TARC/CCL17, TNF-α |
| Mouse | Luminex | Cytokine | 23 | IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12 (p40), IL-12 (p70), IL-13, IL-17A, Eotaxin, G-CSF, GM-CSF, IFN-γ, KC, MCP-1 (MCAF), MIP-1α, MIP-1β, RANTES, TNF-α |
| Rat | Luminex | Cytokine | 23 | G-CSF, GM-CSF, GRO/KC, IFN-γ, IL-1α, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, IL-10, IL-12(p70), IL-13, IL-17A, IL-18, M-CSF, MCP-1, MIP-1α, MIP-3α, RANTES, TNF-α, VEGF |
| Human | MSD | Cytokines | 10 | GM-CSF, IL-1α, IL-5, IL-7, IL-12/IL-23p40, IL-15, IL-16, IL-17A, TNF-β, VEGF-A |









 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


