对肿瘤抗原具有高度特异性的TCR基因工程,称为T细胞嵌合抗原受体(CAR T细胞)。在该技术中,从携带肿瘤的患者中获得 T 细胞,并通过慢病毒或逆转录病毒插入所需的基因,然后将其输入患者体内。由于这些细胞是自体的,因此不存在 GVHD(移植物抗宿主病)的风险。
CAR 含有具有 TCR 细胞内结构域的抗原受体和适当的共刺激分子可以绕过肿瘤细胞拥有功能性抗原机制并通过 MHC I 或 II 类分子表达抗原的需要。2008 年神经母细胞瘤试验的另一项实验是 Epstein-Barr 病毒 (EBV) 特异性工程 T 细胞,共表达一种靶向二唾液酸神经节苷脂 GD2 的 CAR,经治疗后一半的患者表现出肿瘤消退。CAR Ts对血癌比对实体瘤更有效,实体瘤微环境是抑制性的,与MDSC、TAMs、Tregs相关,因此可以分泌IL-12(促炎细胞因子)的CAR T细胞提高了疗效。FDA 批准的两种 CAR-T 疗法(靶向 CD19)用于复发/难治性弥漫性 B 细胞淋巴瘤(DLBCL)和复发/难治性 B 细胞前体急性淋巴细胞白血病(ALL)。因此,CAR T 疗法的发展是一项热点研究,它可以提供更好的预后和更好的特异性。
一篇发布于Science的手稿详细叙述了用于治疗心脏损伤的体内产生CAR T细胞制备及效果的分析。

结果
脂质纳米粒中RNA的合成及包装
CD5/LNP-FAPCAR在体外产生功能性、基于mRNA的FAP CAR T细胞。
1、随着FAPCAR T细胞数量的增加,表达FAP的HEK293T细胞的杀伤作用增强。
2、体外与CD5/LNP-GFP混合24小时后,人类ACH2永生化T细胞表达GFP。
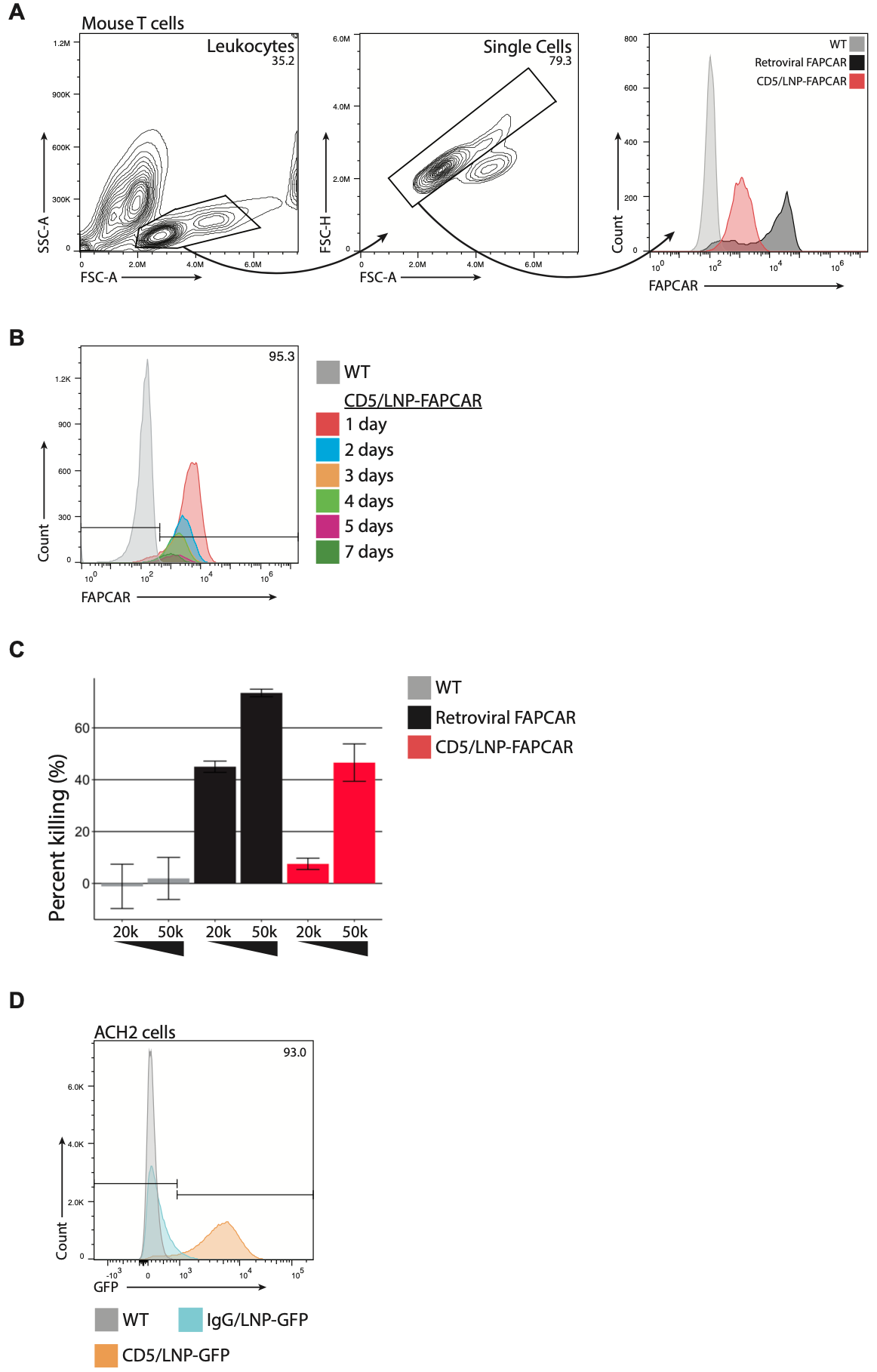
CAR T细胞制备
CD5靶向脂质纳米粒在体内产生基于mRNA的FAPCAR T细胞。
1、注射24小时,仅在注射CD5靶向动物的动物中,荧光素酶的脾脏表达;
2、注射48小时,AngII/PE损伤1周的动物脾T细胞显示FAP CAR染色,而生理盐水、非靶向(IgG/LNP-FAPCAR)或CD5靶向的、不相关的mRNA(CD5/LNP-GFP)LNP对照中未显示FAPCAR染色;
3、注射24小时后显示了封闭种群。

重输入
FAPCAR T细胞从活化的心脏成纤维细胞中转胞糖化FAP,并仅在AngII/PE损伤、FAPCAR治疗的动物中将FAP返回脾脏。
1、过继转移病毒工程107 FAPCAR-GFP T细胞后1、2和28天,AngII/PE损伤(7天)动物的脾脏白髓中仅存在trogocytosis。
2、过继转移12周后,脾脏中的FAP+T细胞数量显著减少,但可以观察到罕见的细胞。
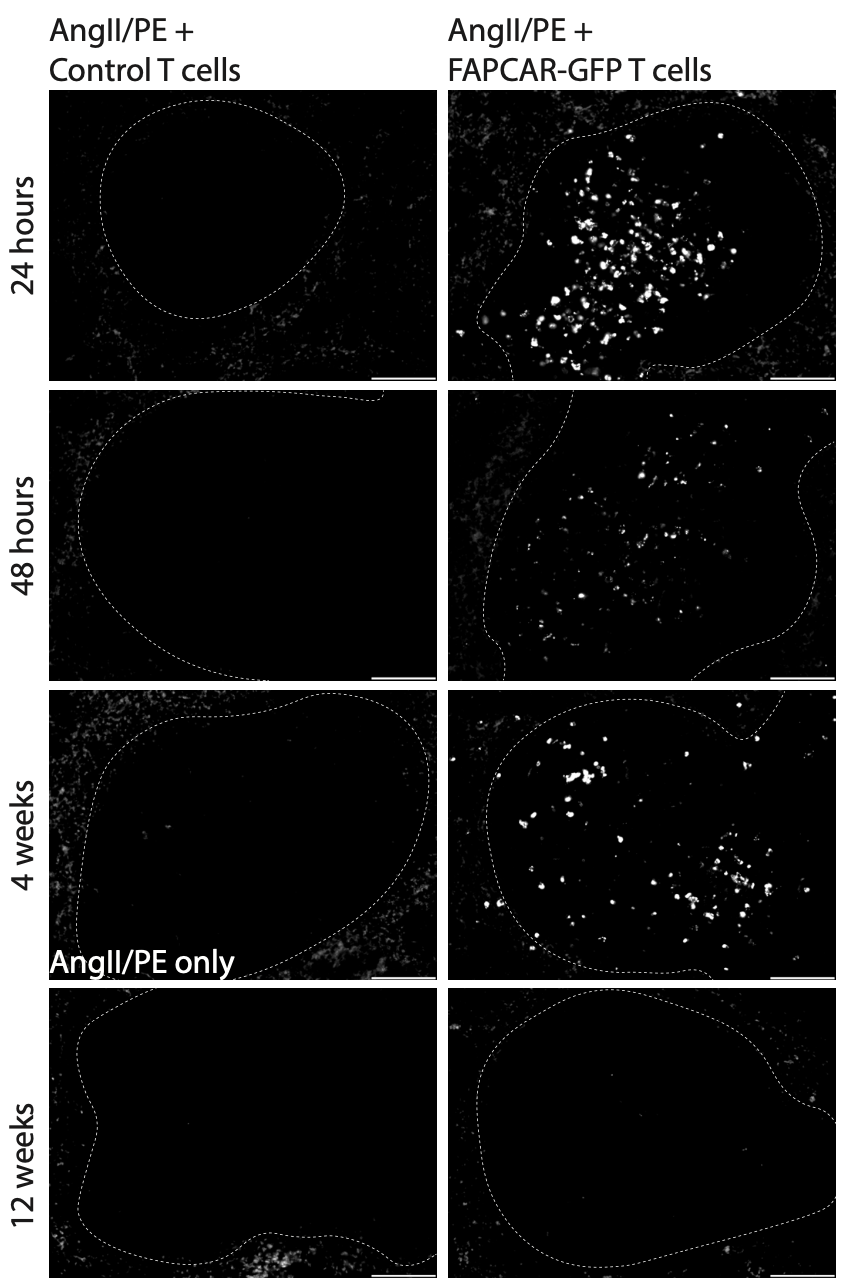

免疫治疗效果
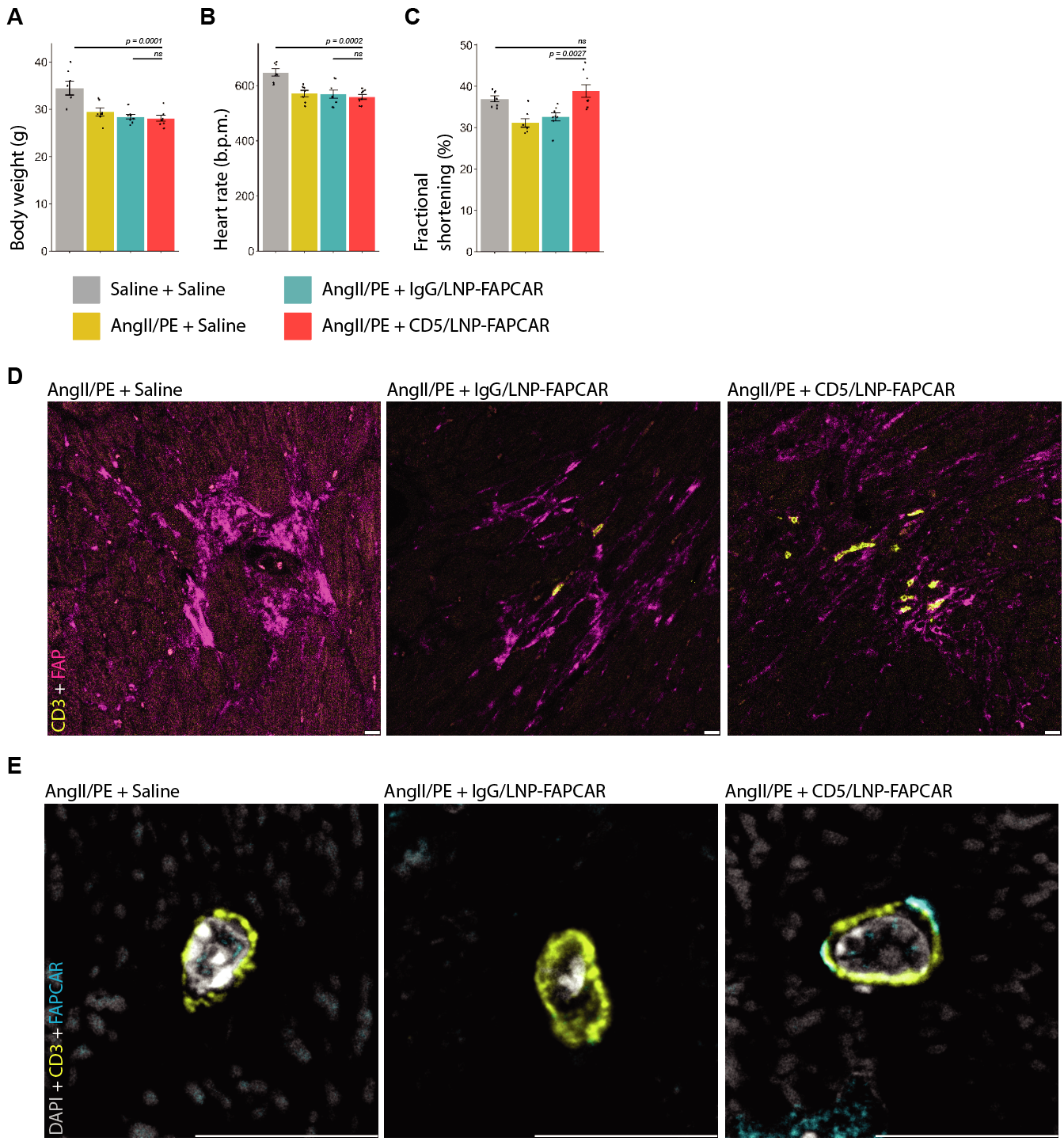
体内产生的FAP CAR T细胞可改善损伤后的心功能、改变损伤后的心肌纤维化。
1、 用FAP(洋红)和CD3(黄色)染色的心脏切片显示,在注射到48小时后,活化的成纤维细胞附近有T细胞聚集。
2、损伤心肌中的CD3+T细胞对FAPCAR可变片段F(ab')2(青色)呈阳性
3、 心脏重量与体重之比(HW/BW,mg/g)在AngII/PE损伤后增加,并在CD5/LNPFACPAR治疗后部分缓解。
4、中心室纤维化百分比的量化显示,仅在CD5/LNP-FAPCAR治疗的动物中,纤维化得到缓解。

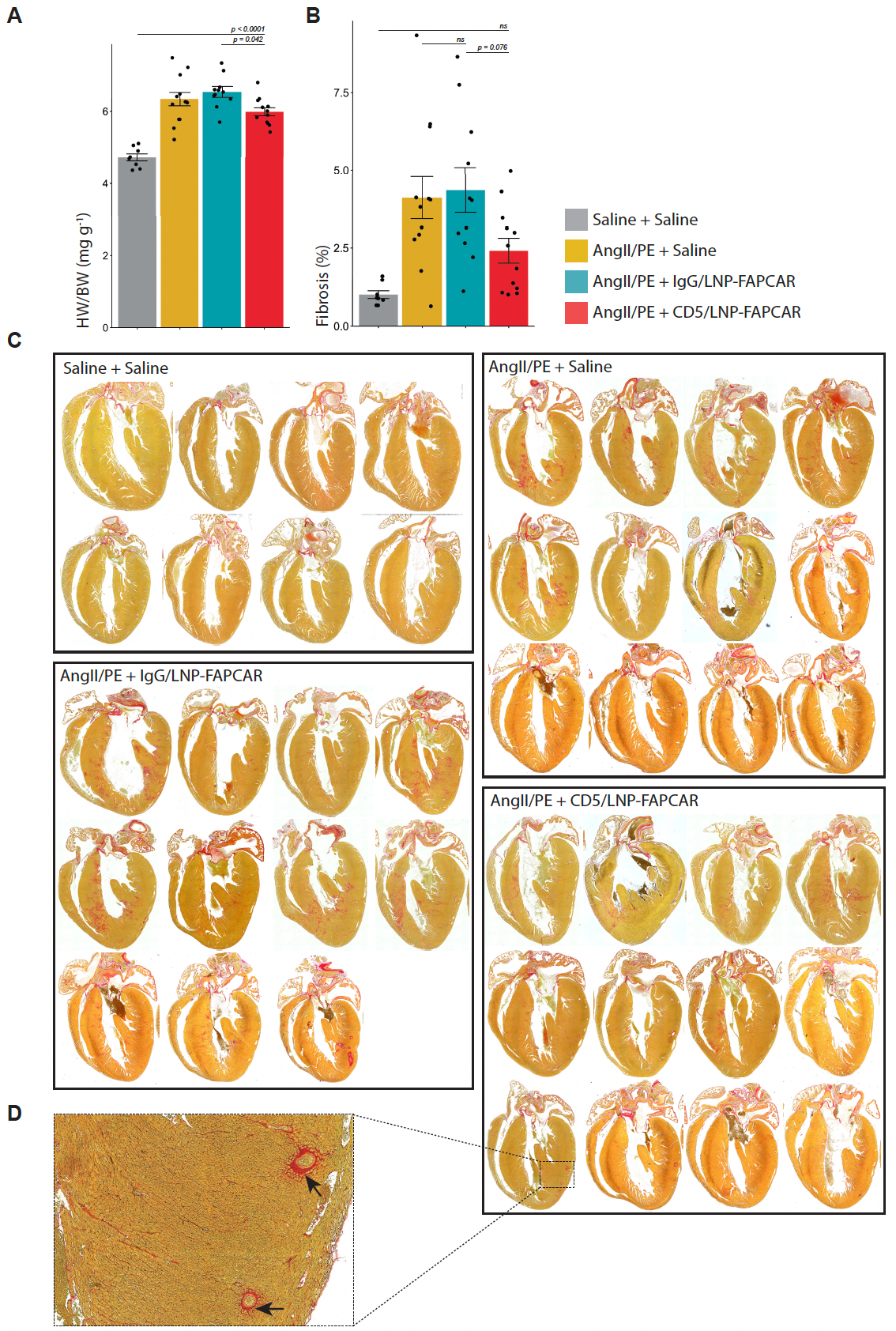
全身影响
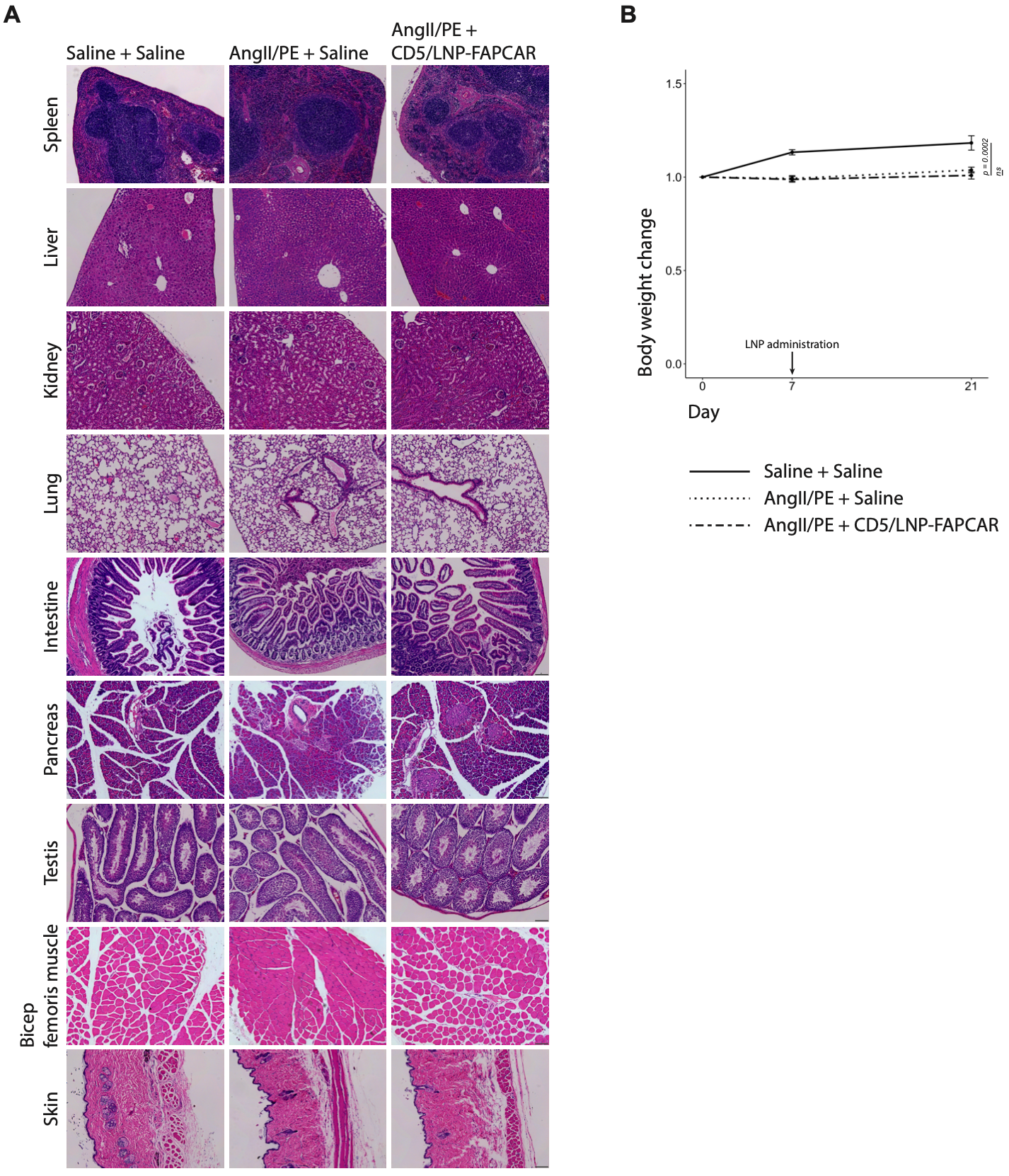
体内产生的FAPCAR T细胞对受伤小鼠的全身影响。
超负荷损伤三周后,经CD5/LNP-FAPCAR治疗的ANGI/PE损伤动物的体重没有下降。
结论
该方法成功地减少了纤维化和恢复心脏功能。使用修饰的 mRNA 在体内产生 CAR T 细胞的能力可能具有许多治疗应用。
讨论
通过在 T 细胞靶向脂质纳米颗粒 (LNP) 中递送修饰的信使 RNA (mRNA),在体内产生瞬时抗纤维化嵌合抗原受体 (CAR) T 细胞。通过将靶向 CD5 的 LNP 注射到心力衰竭小鼠模型中来评估这些体内重编程的 CAR T 细胞的功效。观察到编码 CAR 的修饰 mRNA 向 T 淋巴细胞的有效传递,这在体内产生了瞬时、有效的 CAR T 细胞。抗纤维化 CAR T 细胞在脾脏中积累时表现出吞噬作用并保留靶抗原。用修饰的 mRNA 靶向 LNP 治疗可减少纤维化并恢复损伤后的心脏功能。
多平台多组学的技术应用仍是肿瘤免疫研究的主要方向。如何合理利用不同免疫治疗剂的组合以靶向多种免疫途径,并恢复免疫稳态以成功地对癌症产生适当的免疫反应仍需更多的研究。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


