心理压力会导致免疫功能障碍,从而调节肿瘤的发生和发展。许多研究表明,免疫细胞,包括淋巴细胞和骨髓细胞,含有对应激激素反应至关重要的受体。交感神经系统 (SNS) 调节对压力的反应,包括正常压力和痛苦。根据反应持续时间和其他未知因素,SNS 的激活对生物体具有有利和有害的影响。交感神经反应的全身特征表明,肿瘤微环境中的肿瘤、免疫或基质细胞可能会受到远处甚至局部压力相关激素水平变化的影响。

以下是作者的总体实验思路
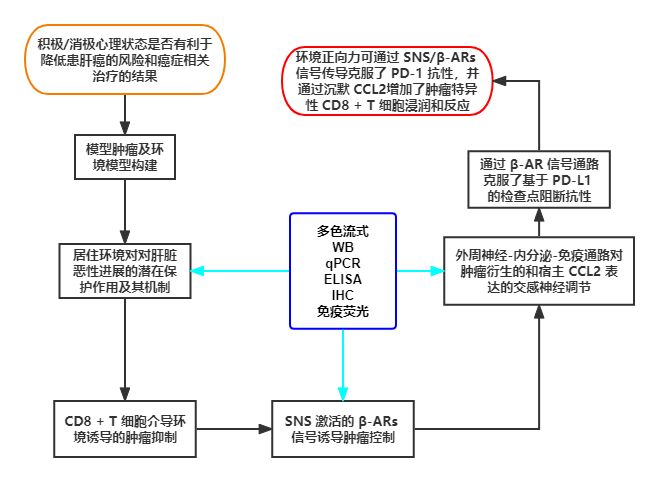
结果
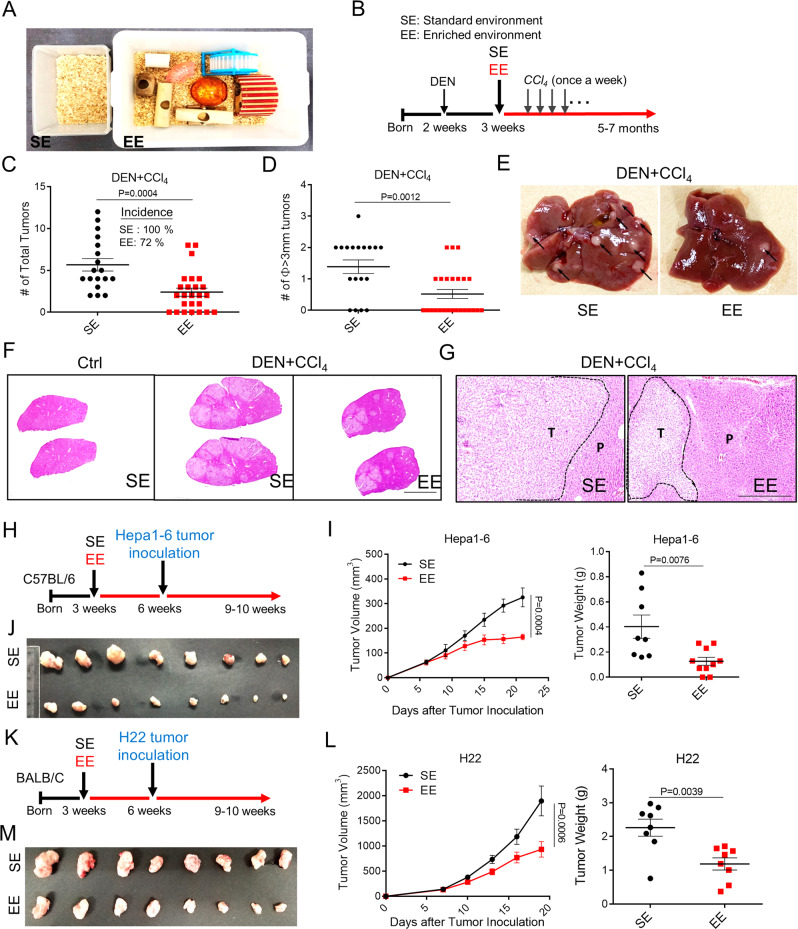
环境差异可介导肝癌的发生和肿瘤的生长
利用三种致癌物或饮食诱导的肝肿瘤小鼠模型,结果显示:
1、100% 的SE 小鼠在 5 个月大时发生肝肿瘤;72% 的 EE 小鼠发展为肝脏肿瘤,肿瘤数量和大小减少;
2、EE 促进了小鼠对 DEN/CCl 4诱导的肝纤维化、肝细胞腺瘤/癌的保护;
3、EE 持续降低 DEN/HFD 模型和 CCl 4诱导的 HCC 模型中的肿瘤数量和肿瘤大小。
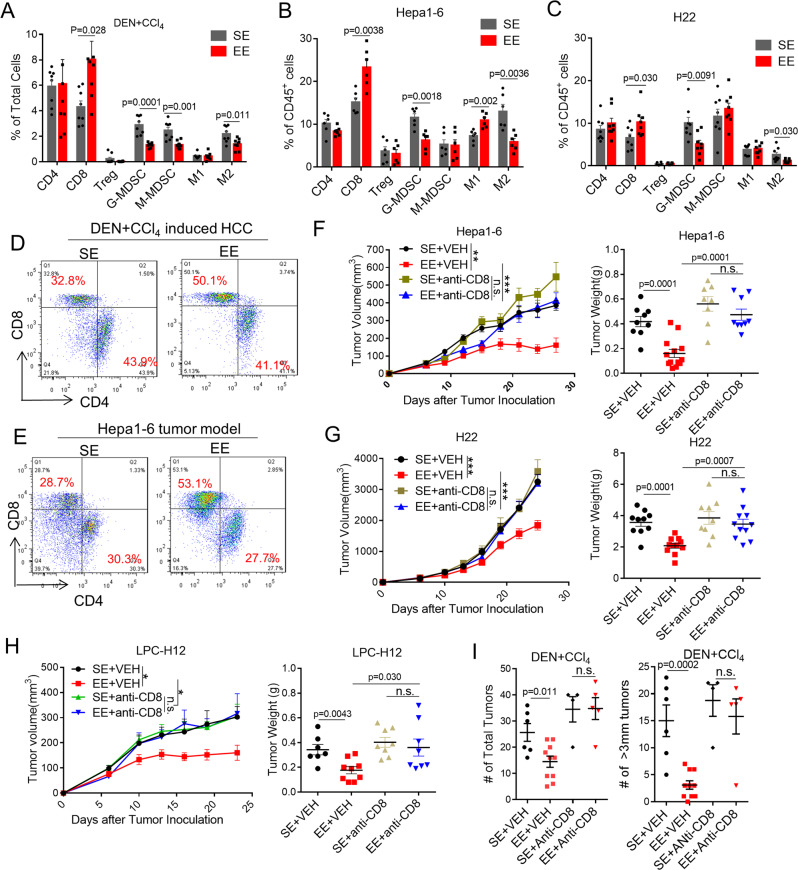
EE 介导的抗肿瘤作用取决于 CD8 + T 细胞
肿瘤浸润的免疫细胞流式细胞术分析显示:
1、与 SE 小鼠相比,EE 小鼠中DEN + CCl4肿瘤 CD8 + T 细胞显著增加,而 M-MDSC、G-MDSC 和 M2 样 TAM 显著减少;
2、虽然 EE 在 CD4 + T 细胞和 NK 细胞耗竭后仍负责肿瘤生长,但 CD8 + T 细胞耗竭消除了 EE 对 Hepa1-6 的抗肿瘤作用,表明EE 介导的肿瘤抑制需要CD8 + T 细胞,而非 CD4 + T 或 NK 细胞;
3、EE通过抑制 TAM 和 G-MDSC 浸润来增加 CD8 + T 细胞。
结果提示:EE重塑了免疫抑制性肿瘤微环境,增强了CD8 + T细胞介导的抗肿瘤免疫。
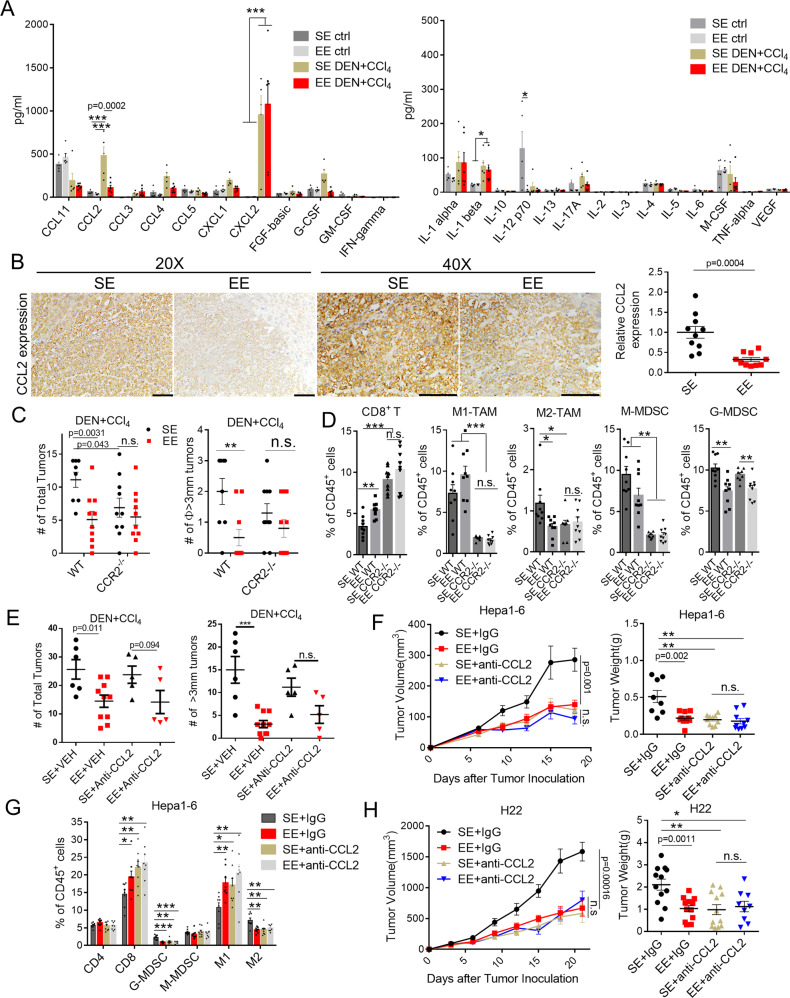
需要 CCL2/CCR2 信号传导
研究发现,环境正常压力和痛苦在影响炎症反应方面发挥着重要作用。Luminex细胞因子/趋化因子谱及IHC检测显示:
1、SE 环境下,与野生型小鼠相比,DEN/CCl 4处理的小鼠中趋化因子 CCL2、CCL3、CCL4、CXCL1、CXCL2、G-CSF 和细胞因子 IL-1β 水平升高;
2、EE 外壳对野生型小鼠的血清炎症因子水平没有明显影响,但显著降低了 DEN/CCl 4刺激的 CCL2 的水平;
3、在 SE 小鼠中阻断 CCL2 模拟了 EE 介导的肿瘤微环境重塑的作用,即 CD8 + T 细胞和 M1 样 TAM 增加,G-MDSC 和 M2 样减少;
4、敲除肿瘤来源的CCL2或宿主来源的CCL2可以抑制肿瘤生长,并部分降低EE的抗肿瘤作用。相反,阻断肿瘤来源和宿主来源的 CCL2 信号传导消除了 EE 的保护功能。
结果提示:CCL2可能是EE诱导的抗肿瘤免疫和重塑肿瘤微环境的关键。
通过交感神经系统增强β-AR信号以控制肿瘤
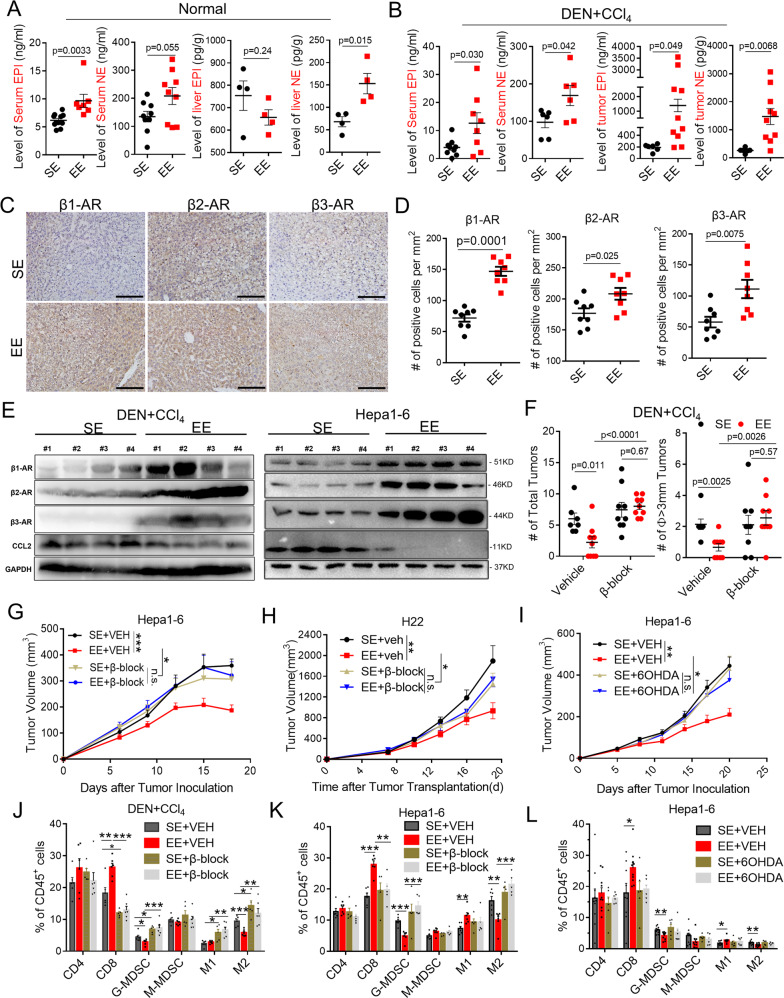
β-ARs 信号通路的激活抑制 CCL2 的表达和释放
鉴于环境正常应激特异性降低了肿瘤微环境中的 CCL2 水平并激活了 β-ARs 信号传导,且鉴于 EE 介导的肿瘤控制中两种信号传导的本质,作者通过原位免疫染色、流式细胞术等鉴定这些信号传导的相关性:
1、β1-AR、β2-AR和β3-AR在肿瘤细胞和免疫细胞中广泛表达;
2、阻断 β-ARs 信号传导(PROP + SR,阻断所有 β-ARs)显著消除了 EE 诱导的血液中 CCL2 的降低;
3、EE 条件可显著降低了血清和肿瘤组织中 CCL2 的表达水平,其效果被β-ARs信号通路的阻断所破坏;
4、使用 6OHDA 诱导的交感神经切除术测试了外周 SNS 对肿瘤部位 CCL2 表达提示:与 β-AR 阻滞剂类似,6OHDA 治疗也消除了 Hepa1-6 肿瘤组织中 EE 诱导的 CCL2 抑制。
5、流式细胞术显示:EE 外壳导致肿瘤细胞和免疫细胞(包括 TAM 和 G-MDSC)中 CCL2 的 mRNA 表达显著降低。
结果提示: β-ARs 作为肿瘤调节的外周神经-内分泌-免疫通路对肿瘤衍生的和宿主 CCL2 表达的交感神经调节。
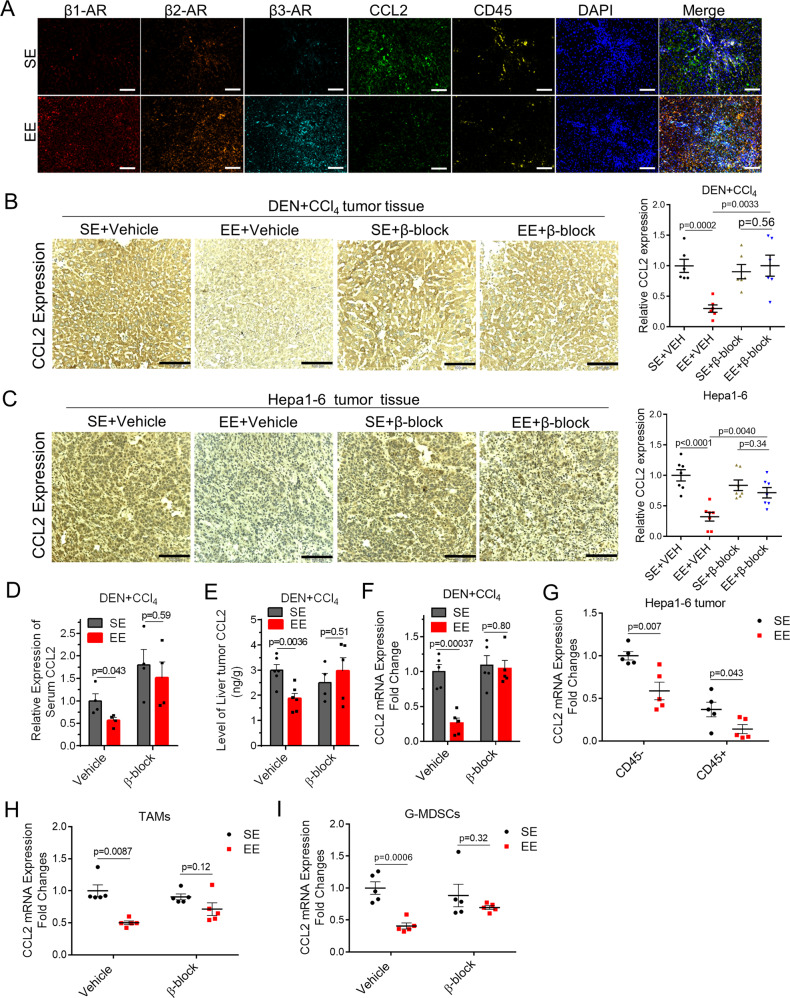
EE 克服了基于 PD-L1 的检查点封锁阻力
只有少数 HCC 患者对基于 PD-1 的免疫疗法有反应。PD-1 耐药患者通常表现出明显的上调基因特征,这些基因参与免疫抑制、血管生成、单核细胞和巨噬细胞趋化性。环境正常压力重塑了免疫抑制性肿瘤微环境并诱导了抗肿瘤免疫,那么 EE 是否能有助于克服 PD-1 耐药性?后续研究结合了 EE 环境和抗 PD-L1 治疗:
1、在 SE 小鼠中,DEN + CCl 4治疗导致肝脏中出现许多肿瘤结节,这些肿瘤结节对 PD-L1 免疫治疗无效;
2、在 EE 小鼠中,肿瘤的数量和大小显著减少。组中的小鼠表现出强大的肿瘤控制和最小化的肿瘤大小;
结果显示,在 PD-L1 阻断的 EE 小鼠中,产生肿瘤反应性 IFN-γ 的 T 细胞协同增加。这些数据表明,当与 PD-L1 阻断相结合时,EE 外壳增强了肿瘤免疫原性并增加了 CD8 + T 细胞浸润和肿瘤特异性 CD8 + T 细胞反应。证明了 EE 和 PD-L1 阻断在对照免疫治疗难治性 HCC 肿瘤中的有效协同作用。
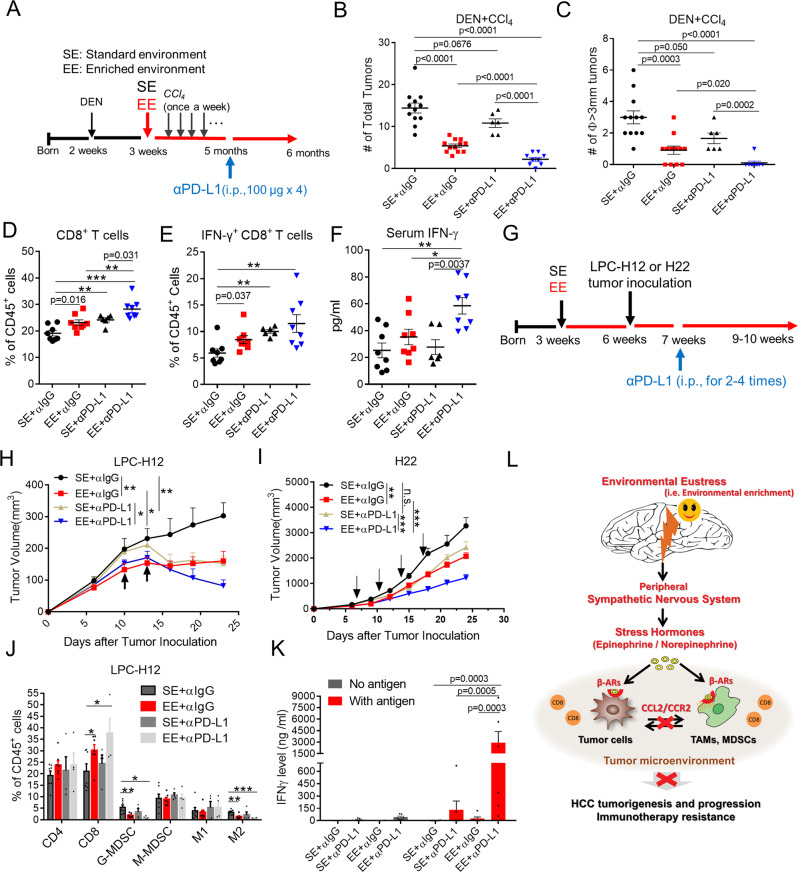
结论
作者通过颠覆 β-ARs/CCL2 介导的免疫抑制作用,建立了环境正常应激与肝癌发生和进展之间的因果关系。证明了由于 CD8 + T 细胞依赖性肿瘤对照,与 SE 相比,生活在 EE 中的小鼠对致癌物诱导的肝肿瘤和可移植的同基因肝肿瘤表现出更好的保护作用。环境正应力激活外周 SNS,适度升高血浆 NE 和 EPI,并增强配体和受体水平的 β-ARs 信号传导。肿瘤细胞和免疫细胞中β-ARs的激活直接沉默了CCL2的表达,导致免疫抑制性肿瘤微环境和检查点阻断难治性肿瘤对抗PD-L1治疗的反应显著增强。
讨论
越来越多的证据表明:免疫抑制性骨髓细胞是连接压力和免疫反应的主要细胞类型。此外,一些报告显示 CCL2 会损害癌症免疫治疗,因此其阻断可能对癌症治疗的结果有益。在这里,作者发现 eustress 通过 SNS/β-ARs 信号传导克服了 PD-1 抗性,并通过沉默 CCL2增加了肿瘤特异性 CD8 + T 细胞浸润和反应。
并发现了一条外周神经内分泌免疫通路 SNS/β-ARs/CCL2以缓解肿瘤免疫抑制并克服 PD-1 免疫治疗耐药性。此外,更是提供了关于 eustress 如何在癌症预防和控制中发挥作用的见解,以确保癌症患者获得更好的治疗结果和更有效的治疗方法。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


