巨噬细胞是肿瘤微环境中最重要的参与者之一。肿瘤相关巨噬细胞分化为促炎 M1 型或抗炎 M2 型,极化状态可能会影响癌症进展和患者生存。细胞外囊泡 (EVs)包含参与细胞间信号传递的不同生物分子。研究表明,癌症衍生的 EVs 被巨噬细胞吸收并调节它们的表型和细胞因子谱。
细胞外囊泡(EVs)是肿瘤-宿主相互作用的重要介质。EVs包含几类生物分子,如蛋白质、脂质和碳水化合物,以及不同种类的RNA(mRNA、miRNA、piRNA、rRNA、tRNA片段和其他非编码RNA)。基于它们的货物,EVs被认为是细胞之间的分子信号传递介质,并且被认为参与生物过程的调节以及靶向受体细胞中的细胞功能和基因表达。如:由来自非小细胞肺癌细胞系、神经胶质瘤细胞和胃癌细胞系的EVs介导的自分泌信号增加了细胞增殖。癌症衍生的EV能够诱导血管生成是癌症进展的固有过程。此外,癌症衍生的EVs通过细胞外基质的降解和细胞外透明质酸的产生增加来调节微环境,从而促进癌细胞的侵袭,从而积极促进转移。EVs可能通过诱导生长因子信号(如血管内皮生长因子、成纤维细胞生长因子和转化生长因子β(TGF-β))在远处组织中形成转移性生态位。挪威拉脱维亚大学医学院研究了THP-1单核细胞对原发性和转移性CRC细胞系衍生的EV的摄取,以及这些EVs 对不同巨噬细胞极化状态下单核细胞和巨噬细胞的免疫表型、细胞因子和趋化因子谱的影响。让我们一起详读该篇文章的思路吧!

以下是文章的实验思路
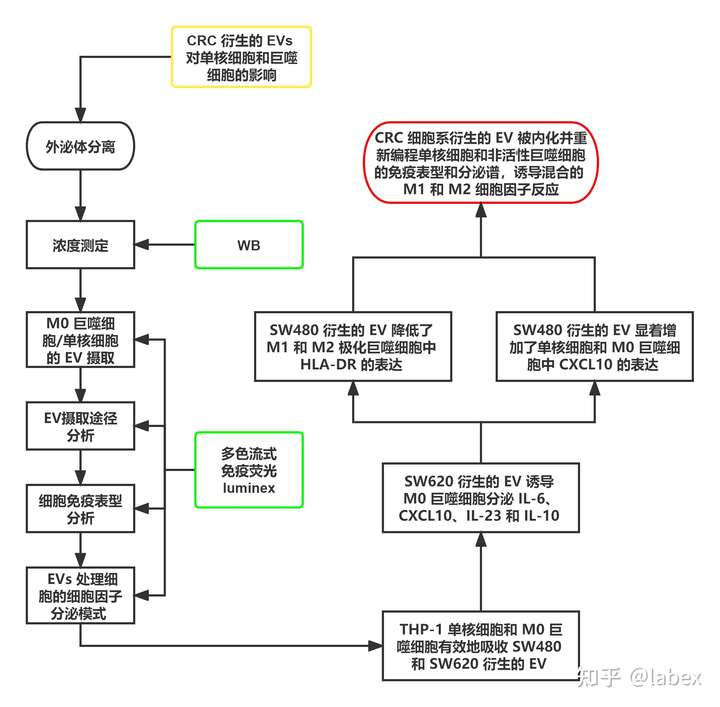
肿瘤来源的 EVs 的免疫调节作用可能会降低自然杀伤细胞、细胞毒性 T 细胞和抗原呈递细胞的活性。巨噬细胞是肿瘤微环境 (TME)中存在的最丰富的免疫细胞类型之一。已知巨噬细胞的两种主要极化状态:经典激活型 (M1) 和替代激活型 (M2)。M1 巨噬细胞由辅助型 1 型 T细胞因子诱导,如 IFN-γ 和微生物脂多糖。它们产生促炎细胞因子、趋化因子和活性氮/氧中间体,因此参与抗微生物和杀肿瘤活性。相比之下,M2 巨噬细胞由 IL-4 和 IL-13 诱导,并显示出免疫调节、抗炎和促肿瘤活性。TME 中存在的大多数巨噬细胞具有 M2 极化细胞的特征,并且肿瘤相关巨噬细胞 (TAM) 具有促肿瘤发生特性。结直肠癌 (CRC)、肺癌、胃癌 和激素受体阳性和三阴性乳腺癌等各种实体瘤中大量巨噬细胞与患者有关在总生存期、无病生存期、转移形成和淋巴结受累方面预后较差。TAM 被认为是肿瘤进展和转移的关键,也是癌症相关死亡的主要原因。
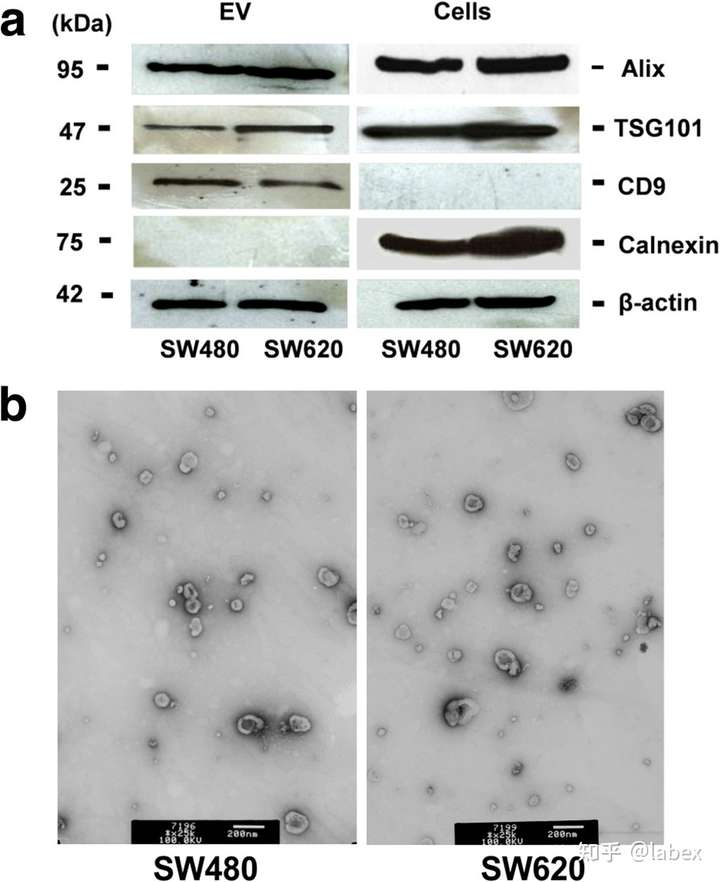
EV的表征
来自 SW480 和 SW620 细胞的 EVs 均含有 EVs 相关标记物 ALIX(PDCD6IP)、TSG101 和 CD9。EVs 对内质网蛋白 Calnexin 呈阴性,从而证实 EVs 制剂在很大程度上没有被细胞成分污染。TEM 显示颗粒具有通常使用我们使用的方案观察到的杯形形态,并且尺寸范围从 30 到 130 nm。
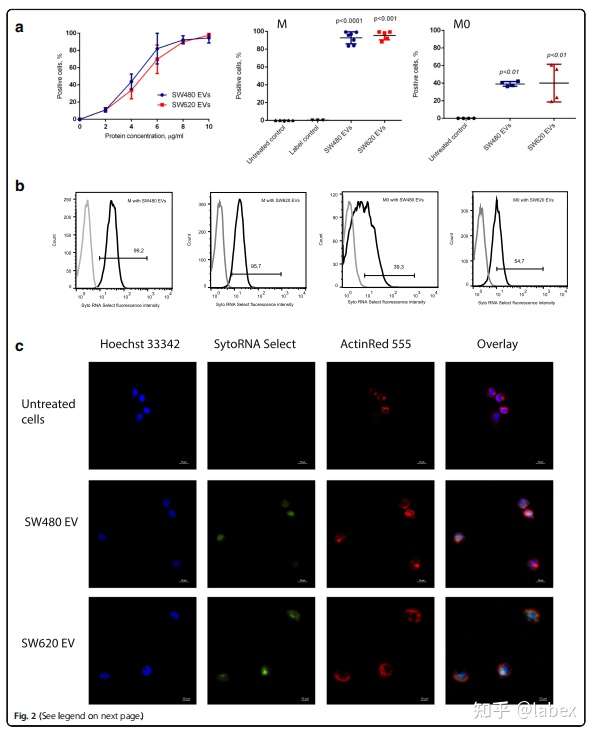
可被单核/巨噬细胞吸收
实验验证出 10 μg/mL 的 EVs 浓度最佳,流式细胞术进一步验证了该结果。在M0和M1巨噬细胞观察到EVs孵育后有轻微的细胞毒性,但细胞活力在可接受范围内。
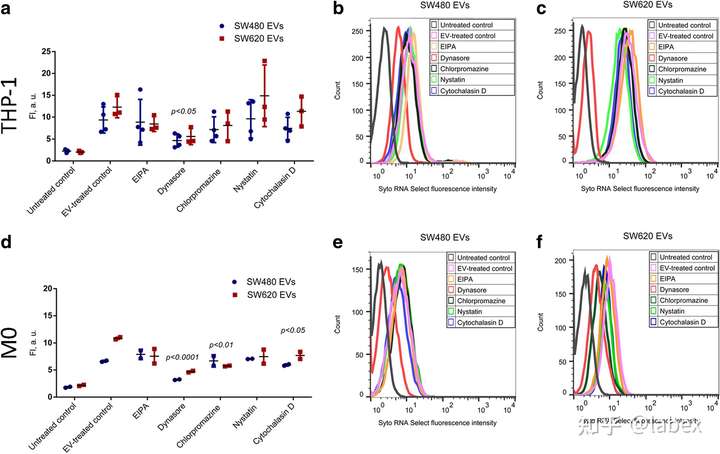
内吞途径
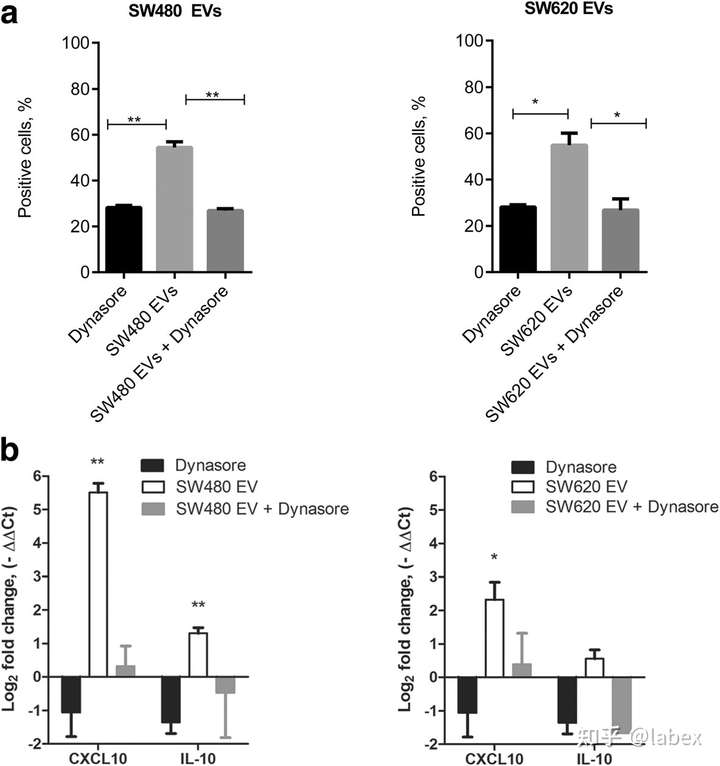
在与 Syto RNA Select 标记的 SW480 EV 和 SW620 EVs 一起孵育的 THP-1 单核细胞中,dynasore 水合物的荧光强度(FI)分别降低了 49.8% 和 54.6%。在 M0 巨噬细胞中,SW480 和 SW620 EVs 的摄取也被 dynasore 水合物抑制(FI 分别降低了 53.3% 和 56%)(d - f)。此外,M0 巨噬细胞对 SW620 细胞衍生的 EVs 的摄取受到氯丙嗪(45.6%)和细胞松弛素 D(27.9%)的抑制(d - f)。其他抑制剂略微降低了 EVs 摄取,但无显著性差异(a、d)。对照实验表明,THP-1 单核细胞中的 EVs 吸收在 + 4 °C 时完全消失。
可改变单核/巨噬细胞表面标志物的表达
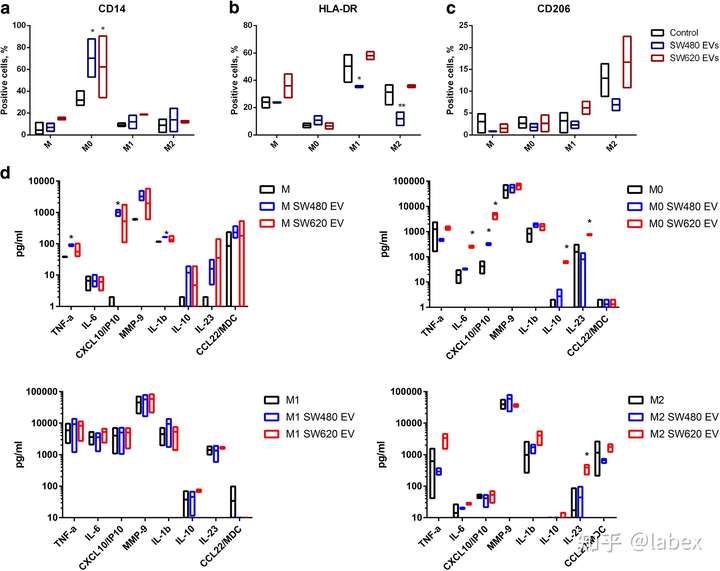
暴露于 SW480 和 SW620 EVs 显著增加了 M0 巨噬细胞中 CD14 的表达(a),SW480 EVs 降低了 M1 和 M2 巨噬细胞中 HLA-DR 的表达(b),但不会导致任何巨噬细胞亚群中 CD206 表达的统计学变化(c)。
影响细胞因子/趋化因子分泌谱
暴露于 SW480 和 SW620 EVs 后 THP-1 单核细胞和 M0 巨噬细胞中细胞因子和趋化因子分泌的显着改变。暴露于 SW480 细胞衍生的 EV 显着增加了单核细胞中的 CXCL10、TNFα 和 IL-1β 水平,而在无活性的 M0 巨噬细胞中,CXCL10 的产生被诱导(d)。暴露于 SW480 EVs 对 M1 或 M2 极化巨噬细胞中细胞因子的产生没有显着影响(d )。此外,SW620 EVs 诱导无活性 M0 巨噬细胞中混合 M1(CXCL10、IL-6、IL-23)和 M2(IL-10)细胞因子分泌模式和 M2 极化巨噬细胞中 IL-23 的产生(d)。 dynasore 水合物抑制 EV 对CXCL10和IL-10 mRNA 表达的影响,证实 M0 巨噬细胞中的细胞因子和趋化因子诱导是由 EVs 处理引起的(b)。
总结
研究使用 THP-1 单核细胞分化模型分析了两种同基因 CRC 细胞系 SW480 和 SW620 衍生的 EVs对单核细胞和巨噬细胞的内化和功能影响。数据显示:
1、THP-1 单核细胞内化 SW480 和 SW620 衍生的 EVs,并且 EVs 摄取被 dynasore 抑制。2、 M0 巨噬细胞中,SW480 和 SW620 EV 摄取受到 dynasore 和氯丙嗪的抑制。此外,M0 巨噬细胞对 SW620 EVs 的摄取受到细胞松弛素 D 的抑制3、THP-1 单核细胞和 M0 巨噬细胞中 SW480 和 SW620 衍生 EVs 的内吞作用主要依赖动力蛋白。4、在 LPS 和 IFN-γ 诱导M0 巨噬细胞极化为 M1 巨噬细胞。IL-4 和 IL-13 存在的情况下,极化为 M2 巨噬细胞(通过成纤维细胞样扩展形态和 CD206表达证实)。M1巨噬细胞分泌IL-6、CXCL10、IL-10和IL-23,而M2巨噬细胞产生CCL22。M1和M2极化巨噬细胞都分泌IL-1β、TNFα和MMP9。5、暴露于 CRC 细胞系衍生的 EV 会增加 M0 巨噬细胞中表面标志物 CD14 的表达。6、单核细胞和M0巨噬细胞暴露于CRC EV s可能有助于单核细胞向TME迁移和TAM诱导促炎反应。两种CRC EVs 类型都会引起单核细胞和非活性巨噬细胞分泌谱的显著改变。此外,观察到SW480和SW620 EVs 在M0巨噬细胞中的CD14表达增加,SW480衍生的EV在M1和M2极化巨噬细胞中的HLA-DR表达降低。
讨论
SW620 细胞系衍生的 EV 在无活性(M0)巨噬细胞中诱导混合 M1 /促炎(CXCL10、IL-6 和 IL-23)和 M2 /抗炎(IL-10)细胞因子分泌模式,患者血液中 CXCL10 和 IL-6 水平升高与晚期 CRC 分期相关,并且 IL-6 被认为是生存的独立不良预后标志物。术前血清 IL-10 水平升高与 CRC 患者的不良生存相关。据报道,在肠道炎症期间,巨噬细胞产生的 IL-23 诱导促炎细胞因子 IL-6 和 IL-17 的产生。此外,Treg 和 Th17 细胞属于 IL-23 靶细胞。IL-23 对于 Th17 淋巴细胞的分化至关重要,在 CRC 中诱导 IL-23 与更具侵袭性的疾病有关。因此,CRC EVs 可能通过 Th17 细胞激活对癌症进展产生影响。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


