口腔扁平苔藓(OLP)是一种具有自身免疫特征的慢性炎症性疾病,主要累及口腔黏膜,病因不明。调查显示:全球约 0.5%-3% 的女性好发,已被 WHO 认定为口腔潜在恶性疾病。
武汉大学的研究团队为研究 T 细胞衍生的外泌体(T-exos)对 OLP 发病机制的影响及其机制,进行了一项系列研究(87名口腔患者及44名健康志愿者)。
结果提示:OLP T-exos 提高了 MIP-1α/β 的产生,MIP-1α/β 在 OLP 组织和血浆中高度表达。此外,MIP-1α/β促进了OLP单核细胞的迁移,而抑制CCR1/5则显着降低了单核细胞的迁移,尤其是CD8 + T细胞的迁移。

以下是作者的整体思路
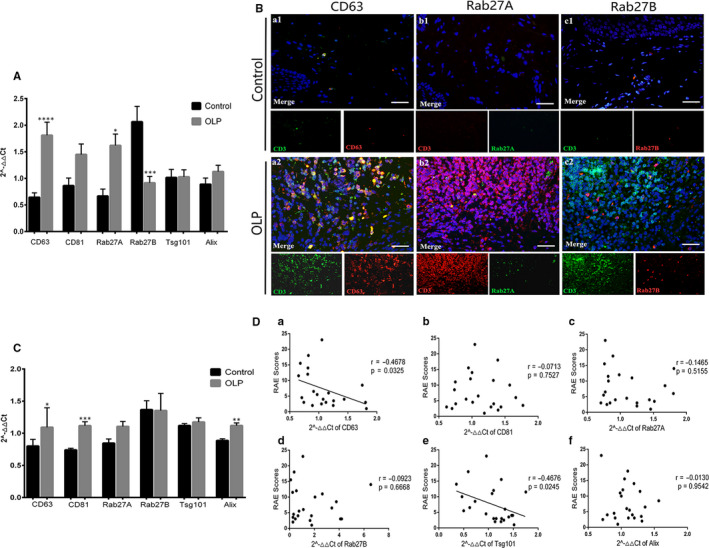
MVB 相关基因上调并与疾病严重程度相关
通过 qRT-PCR 对 6 个代表性 MVB 相关基因进行了初步分析:CD63、CD81、Rab27A、Rab27B、Alix 和 Tsg101。数据表明OLP T细胞释放的外泌体可能与OLP的发病机制有关。
1、与HCs相比,OLP中CD63和Rab27A基因表达显著上调,而Rab27B基因表达显著下调。
2、CD63 在固有层中密集浸润并与 T 细胞共定位。
3、OLP T细胞中CD63、CD81和Alix的基因水平显著高于对照组。
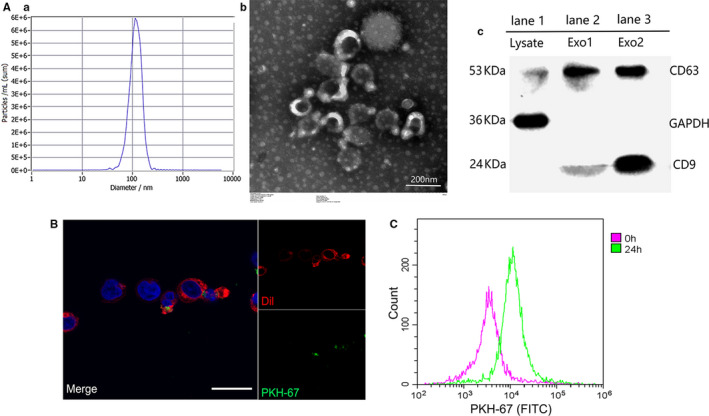
外泌体的鉴定和内化
T 细胞衍生的细胞外囊泡的大小均匀分布,平均大小为 118.7 ± 32.1 nm,直径峰值为 117 nm。将 PKH-67 标记的 T-exos(绿色)与 Dil 染色的 Jurkat 细胞(红色)一起孵育。结果表明:T-exos 在培养 24 小时后被 Jurkat 细胞掺入。
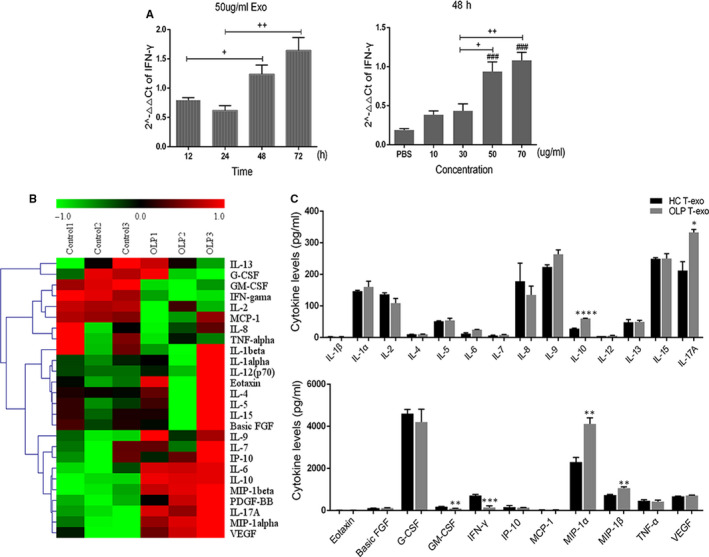 OLP T-exos 促进 MIP-1α/β 的分泌
OLP T-exos 促进 MIP-1α/β 的分泌
将 T-exos 与 Jurkat 细胞共培养,并评估了共培养细胞分泌的细胞因子。结果提示:OLP T-exos处理的Jurkat细胞上清液中IL-10、IL-17A、MIP-1α和MIP-1β上调,GM-CSF和IFN-γ下调,作为CC趋化因子的MIP-1α和MIP-1β变化最为明显,表明OLP T-exos可能通过增加MIP-1α/β的分泌来促进T细胞的迁移。
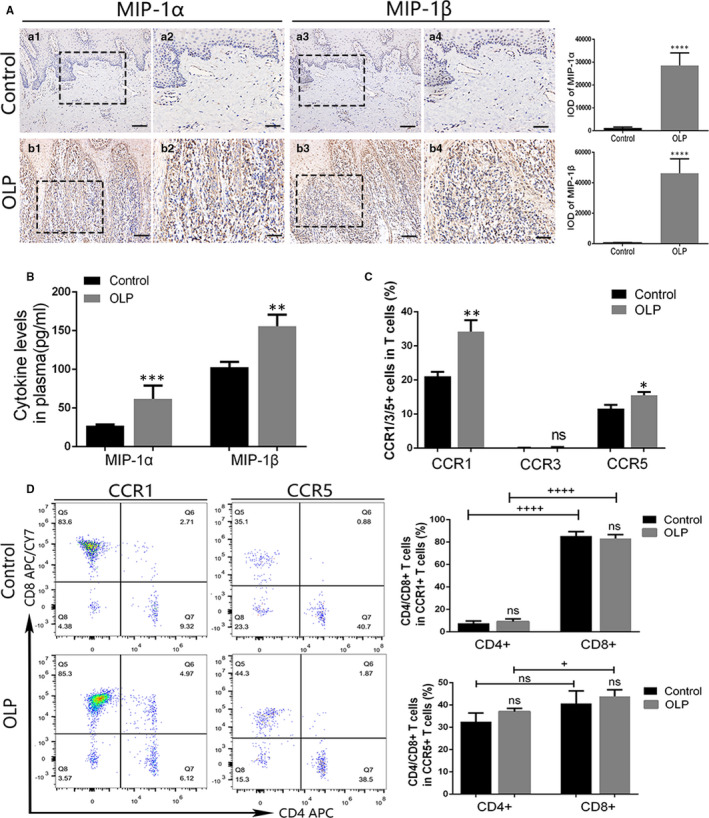
MIP-1α/β 和 CCR1/5 + T 细胞的表达增加
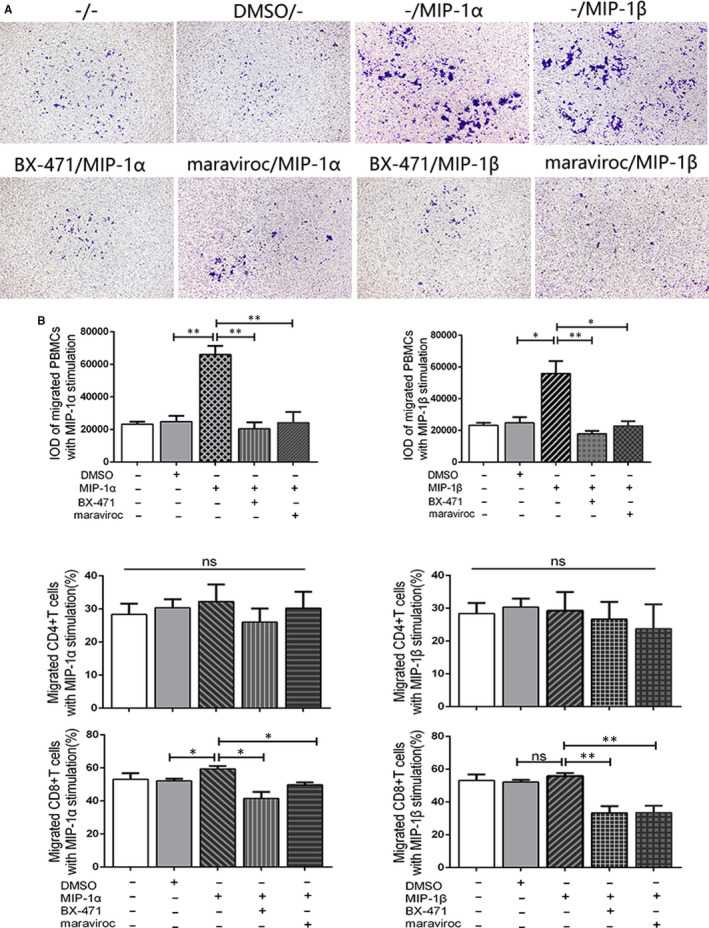
MIP-1α/β通过 CCR1 和 CCR5诱导 OLP CD8 + T 细胞迁移
transwell试验和流式细胞术结果提示:MIP-1α/β刺激显著增强了OLP PBMCs的迁移,对CCR1/5的抑制显著降低了迁移的PBMCs总数。尽管与 DMSO 组相比,MIP-1α 处理提高了迁移的 CD8 + T 细胞的比例,但变化很小。在抑制 CCR1/5 之前,下腔室中的主要亚型是 CD8 + T 细胞。对 CCR1 或 CCR5 的抑制显著减少了迁移的 CD8 + T 细胞的比例。
讨论
淋巴细胞的致密带状浸润是 OLP 最明显的组织病理学特征。 CD4 + T 细胞是上皮下和固有层中的主要淋巴细胞,而在 OLP 病变的上皮内,大多数浸润的淋巴细胞是活化的 CD8 +淋巴细胞。
MIP-1α 和 MIP-1β 是 CC 趋化因子亚家族的成员,可由淋巴细胞、巨噬细胞和其他免疫细胞产生,通过与 T 细胞表面受体 CCR1、CCR3 和 CCR5 结合对 T 细胞发挥趋化作用。 研究显示:体内 CD4 + T 细胞在激活后产生 MIP-1α 和 MIP-1β,免疫后 CD8 + T 细胞上调 CCR5;因此,同源 MIP-1α/β通过 CCR5显着促进了 CD8 + T 细胞向树突细胞-CD4 + T 细胞相互作用位点的积累。
总结












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


