|
癌症相关死亡率的主要原因是肿瘤细胞向远处转移。转移是一个多步骤的过程,包括静脉穿刺、在循环中的生存、外渗、在远处组织的生存和定植。肿瘤在定殖前对远端器官微环境的诱导改变可能会使某些组织更容易接受迁移的肿瘤细胞的定殖。最近的研究表明,原发肿瘤分泌的因子可能直接调节未来的转移部位。中性粒细胞是先天免疫系统的一部分,由于其高度运动的特性,中性粒细胞反应迅速,并通过吞噬、细胞外脱颗粒和细胞外陷阱的扩散提供抵抗感染的第一道防线。本文描述了小鼠肿瘤模型中原发肿瘤转移前期中性粒细胞的积累和激活。由于原发肿瘤的诱导,这些携带肿瘤的中性粒细胞(TENs)在循环和转移前肺中积累。
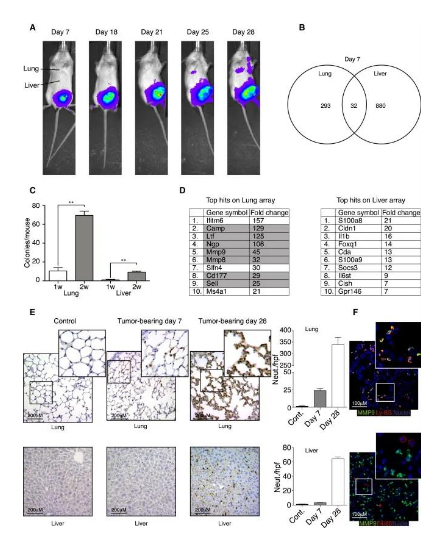
01、 中性粒细胞在转移前的肺组织中积累
作者将4T1肿瘤细胞植入小鼠中,肿瘤细胞主要自发转移到了肺组织中,肝脏,脑会让骨骼的转移率低(图1A)。为确定肿瘤细胞转移前肺组织中是否发生了转录水平的变化,作者对肺和肝组织进行了mRNA微阵列检测分析。与对照组比较,肺和肝组织分别有325和912基因的表达发生了显著变化,其中293个是在肺组织中特异性改变的(图1B)。且在肺和肝脏中的肿瘤细胞量很少(<10个,图1C)。
在肺组织中,一些中性粒细胞特异性的基因上调,肿瘤植入第7天肺中Ly-6G+中性粒细胞增加,且在28天持续积累,并且MMP9与中性粒细胞标志物Ly-6G+共定位(图1D-F)。
02、 荷瘤小鼠中性粒细胞的耗竭
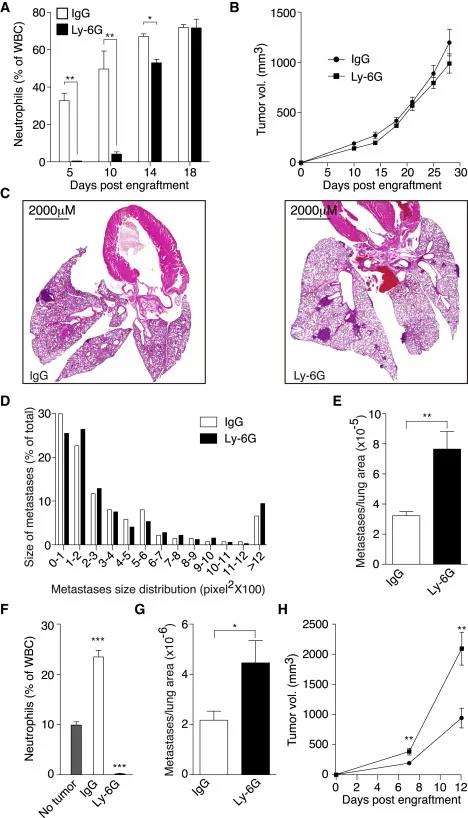
为了明确中性粒细胞在转移前的肺组织中的作用,作者通过注射白细胞特异性消耗抗体使动物中的中性粒细胞不发挥作用。与对照组相比,用Ly-6G抗体治疗的荷瘤小鼠循环中的中性粒细胞数量明显降低,在肿瘤边缘及肺组织中也明显减少(图2A-C)。

03、 肿瘤相关中性粒细胞抑制了转移前肺组织的种植
循环中的中性粒细胞的减少在肿瘤细胞植入的前14天具有显著差异,但之后差异减少,而肺组织转移性种植就是发生在中性粒细胞耗竭的期间。与对照相比中性粒细胞的数量减少,对原发肿瘤的生长速度影响不大,转移灶的大小分布没有显著差异,但对转移的负担增加,转移事件的数量增加了约3倍(图3A-E)。表明肿瘤夹带的中性粒细胞(TENs)抑制了转移前肺的播散。
作者使用MMTV-PyMT/MMTV-cMyc荷瘤小鼠进一步验证,中性粒细胞减少导致肺转移性扩散增强,但中性粒细胞减少导致原发肿瘤生长的适度增强(图3F-H),因此转移的增加可能部分是因为该模型中原发部位的肿瘤体积较大。
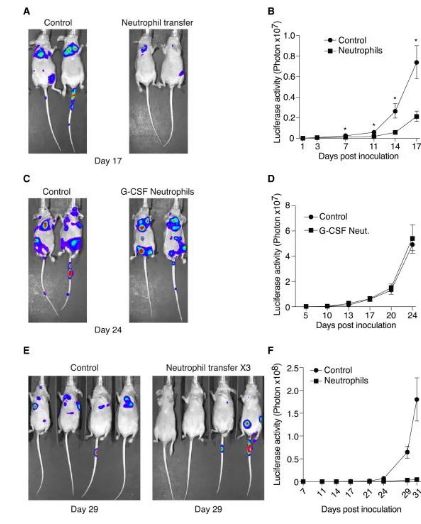
04、 TENs足以提供抗转移保护
为了验证TENs是否可以提供抗转移保护,作者通过尾静脉注射2×104个4T1细胞诱导转移,4小时后,用从4T1荷瘤小鼠中纯化的5×106个TENs细胞处理这些小鼠。TENs的转移导致肺病灶形成明显延迟,而经G-CSF处理的动物中纯化的中性白细胞的转移对肺灶的形成没有显着影响(4A-D)。入肿瘤细胞后的第4、24和48小时连续3天输注TENs时,肺灶几乎全部消融(图4E和4F)。这些观察结果表明,虽然肿瘤初发、G-CSF诱导的中性粒细胞不影响肺病灶的形成,但TENs在体内可提供抗转移保护,并显著减少肿瘤细胞在肺中的扩散。
05、 TENs获得细胞毒性表型并杀死肿瘤细胞
由于中性粒细胞带有大量毒性肽和分子,我们推测TENs可能能够直接杀死肿瘤细胞,从而提供抗转移保护。因此,我们在体外测试了TENs的肿瘤细胞杀伤能力。虽然对照中性粒细胞没有显著的细胞毒性作用,但TENs具有高度的细胞毒性(图5)。当中性粒细胞和肿瘤细胞分开时,未观察到杀伤性,这表明物理接触对于中性粒细胞介导的肿瘤细胞杀伤是必要的(图5B)。MCF7细胞与荷瘤小鼠TENs共培养时观察到类似的杀伤模式(图5B),表明这是一种广泛的现象。
为了最终排除中性粒细胞对植入性肿瘤小鼠的细胞毒性是一种非特异性抗移植物免疫反应的可能性,作者评估了中性粒细胞对自发性MMTV-PyMT驱动的乳腺肿瘤小鼠的细胞毒性。如图5C所示,PyMT诱导荷瘤小鼠纯化的中性粒细胞具有较高的细胞毒性。此外,使用Evans Blue染色,作者发现荷瘤小鼠肺部微血管通透性与对照组相比没有增加的迹象(图5D),这表明TENs可以在体内区分肿瘤细胞和正常细胞(即肺内皮细胞)。
作者想进一步确定TENs的产生是否与人类疾病有关。从健康人类志愿者中分离出的中性粒细胞无细胞毒性,而在肿瘤切除或化疗之前从新诊断的乳腺癌患者中分离出的中性粒细胞具有高度细胞毒性(图5E),这表明中性粒细胞的夹带不是鼠肿瘤模型所独有的,而且发生在人类疾病的自然过程中。
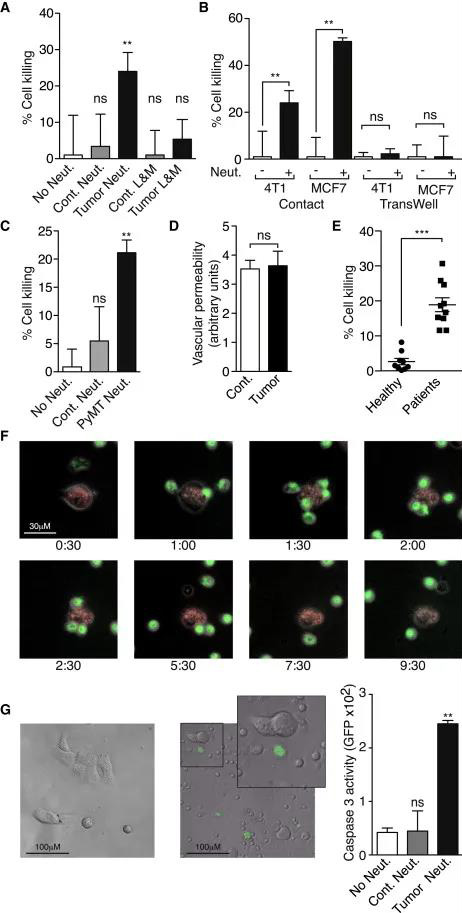
06、 实时可视化TENs细胞毒性
作者使用延时显微镜观察了TENs与肿瘤细胞之间的相互作用。在添加后60分钟,可看到GFP标记的TENs会聚在粘附的4T1细胞上(红色);中性粒细胞开始与肿瘤细胞发生物理接触,这时肿瘤细胞会发生剧烈的形态变化(图5F)。为了确定TENs和肿瘤细胞之间的相互作用是否导致肿瘤细胞凋亡,用Caspase 3荧光底物标记肿瘤细胞;GFP强度作为Caspase 3活化指示剂的量化显示,在TENs的存在下显着增加(图5G)。这些数据表明,TENs通过诱导细胞凋亡来抑制肺中的肿瘤细胞播种,但是,肺毛细血管中传入肿瘤细胞的高自发凋亡率使得直接评估TENs杀死肿瘤细胞成为可能。
07、 TENs的细胞毒性由过氧化氢介导
作者接下来研究了中性粒细胞杀死肿瘤细胞的机制。中性粒细胞可通过NADPH氧化酶复合物的活性生成活性氧(ROS),并通过氧化爆发诱导细胞死亡(图6A)。在apocynin存在下,TENs与肿瘤细胞的共培养可完全抑制中性粒细胞介导的肿瘤细胞杀伤;过氧化氢酶抑制细胞杀伤;次氯酸清除剂(牛磺酸)的存在并不能减少刺激的中性粒细胞对肿瘤细胞的杀伤,表明杀伤是由H2O2导致的(图6B)。TENs比对照中性粒细胞产生更多的H2O2的观察结果进一步支持了这一观点(图6C)。为了进一步了解杀伤机制,我们用PMA(一种有效的H2O2产生活化剂)处理了中性粒细胞。结果显示PMA诱导了幼稚中性粒细胞的H2O2产量急剧增加(图6D)。与4T1细胞共培养时,PMA处理的幼稚中性粒细胞具有高度的细胞毒性,可杀死接近100%的肿瘤细胞,且即使在Transwell系统中被膜隔开时也具有杀死肿瘤细胞的能力(图6E)。该结果表明,PMA刺激的中性粒细胞自发地分泌H2O2,其水平高到可以不需要直接接触就杀死肿瘤细胞。所以作者进一步假设TENs不是自发释放H2O2,而是通过接触触发了H2O2的分泌。为了检验该假设,作者进行了体外实验,尽管TENs产生H2O2增多(图6C),但当它们单独培养时,H2O2的浓度很低(图6F),这表明TENs的H2O2分泌是在肿瘤细胞存在时触发的。
为了测试嗜中性粒细胞抑制转移的过程在体内是否也相关,我们测试了apocynin对自发转移的作用。结果显示,apocynin处理增强转移且更早的发生自发性肺转移(图6G)。这些结果表明中性粒细胞通过NAPDH氧化酶复合物通过产生ROS而诱导肿瘤细胞死亡。然而,是通过H2O2的产生和接触触发的,而不是其他的机制。

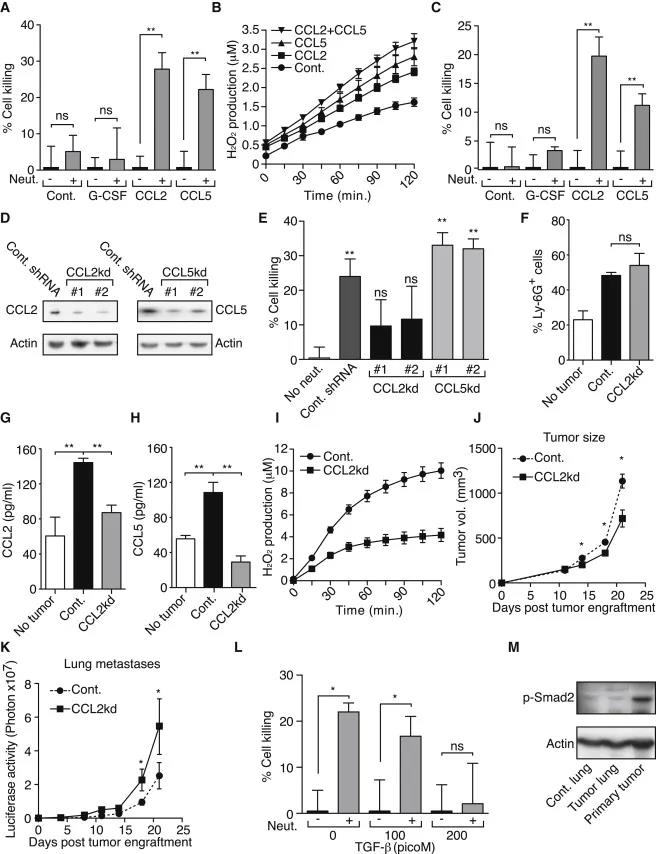
08、 肿瘤分泌的CCL2是嗜中性粒细胞夹带的关键介质
原发性肿瘤激活中性粒细胞的机制是什么?研究表明,携带4T1肿瘤的小鼠血清G-CSF含量高,可能是中性粒细胞积累的原因。然而,它在体内(图4C和4D)或体外(图7A)不诱导细胞毒性中性粒细胞应答。这些观察结果表明,G-CSF分泌足以在嗜中性粒细胞的循环和肺隔离中积累,但是这些嗜中性粒细胞需要进一步活化以夹带其抗转移行为。
因为4T1肿瘤分泌CCL2和CCL5,它们是CCR2和CCR1的潜在配体,我们测试了这些趋化因子是否能诱导中性粒细胞介导的肿瘤细胞杀伤。
结果显示,加入mCCL2或mCCL5均可刺激原始中性粒细胞,并诱导体外肿瘤细胞杀伤,并诱导幼稚中性粒细胞产生H2O2 (图7A-B)。同样,hCCL2和hCCL5都可以刺激从健康志愿者纯化的人类中性粒细胞,并在体外诱导人MDA-MB-231细胞的死亡(图7C)。
作者进一步敲低了CCL2和CCL5的表达,阻断了中性粒细胞的夹带(图7D-E),而不影响中性粒细胞的聚集(图7F)。敲除CCL2导致循环中的CCL2和CCL5水平降低(图7G-H)。与从荷瘤小鼠分离的中性粒细胞相比,CCL2敲低的荷瘤小鼠中积累的中性粒细胞没有被激活,因为其H2O2的产生减少(图7I)。
为了进一步了解肿瘤分泌的CCL2在体内肿瘤生长和转移中的作用,我们比较了原位植入的CCL2基因敲低(CCL2kd)和对照4T1肿瘤的生长和自发转移。我们发现与对照肿瘤相比,原发性CCL2kd肿瘤显示出生长迟缓(图7J)。但是,我们发现CCL2kd肿瘤自发转移的发生较早(图7K)表明这些肿瘤具有增加的转移潜力。
为了进一步了解CCL2在原发部位和转移前部位的不同功能,我们测试了其他肿瘤分泌因子是否具有调节TENs细胞毒性活性的能力。我们发现,4T1肿瘤分泌TGF-β,显著抑制肿瘤细胞的细胞毒性(图7L)。由于4T1肿瘤分泌TGF-β,其在原发肿瘤附近的活性较高, 然而,在较远的部位,如转移前肺,TGF-β活性较低(图7M),这为CCL2在原发部位和转移前部位的不同作用提供了合理的解释。
本文涉及技术: 多重荧光免疫组化
本文涉及技术: 免疫组化
|
















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


