本周为大家带来的文献为2024年4月发表于Adv Sci (Weinh)(IF:15)的文献‘DNMT3A Cooperates with YAP/TAZ to Drive Gallbladder Cancer Metastasis’。

胆囊癌(GBC)是胆道癌症中最常见的类型,也是一种罕见但致死率极高的恶性肿瘤。肿瘤转移是相关死亡的主要原因。GBC进展过程中侵袭性表型的形成源于遗传和表观遗传失调,包括体细胞突变和扩增、DNA甲基化和组蛋白修饰。然而,GBC中这些基因高甲基化的分子机制仍不清楚。
DNA甲基化主要发生在CpG二核苷酸中胞嘧啶的第五个碳(5-甲基胞嘧啶,5mC)上,由DNA甲基转移酶(DNMTs)介导,包括DNMT1、DNMT3A和DNMT3B。研究者曾报道DNMT3A可催化伸长子复合体亚基启动子区内的DNA甲基化,从而产生GBC的化疗抗性,也可作为治疗靶点,但其在推动GBC转移方面的作用仍不清楚,本文旨在探究相关机制。
LabEx提供的PCR array检测服务
通过LabEx提供的PCR array检测技术,研究者检测了84个肿瘤转移相关基因和5个看家基因。

重要发现
通过WB,免疫组化,比较总存活率等研究方法,研究者确定了DNMT3A在病理和临床上与GBC患者的侵袭性和预后有关。为了验证DNMT3A驱动GBC肝转移这一假设,研究者在体外和体内检测了DNMT3A在GBC细胞中的生物学功能,并确定了DNMT3A促进GBC转移的方式取决于其DNA甲基转移酶活性。
为了研究DNMT3A产生的上述结果是否与GBC的侵袭性特征有关,研究者对GBC肿瘤组织的转录组进行了基因组富集分析(Gene Set Enrichment Analysis, GSEA)。研究表明上皮细胞向间质转化(EMT)在高表达DNMT3A的病人中有富集。DNMT3A缺乏会恢复上皮标记CDH1(编码E-cadherin蛋白)的表达,但会降低间质标记N-cadherin的表达。下一步研究者试图确定DNMT3A抑制CDH1转录的机制,以确定其对EMT的促进作用。
研究者通过使用亚硫酸氢盐测序PCR(BSP)检测法来观察CDH1启动子上CGI的甲基化状态,研究DNMT3A能否使GBC细胞中CDH1启动子上的CGI甲基化,再通过MS‐qPCR验证。这些结果表明DNMT3A通过催化CDH1启动子的超甲基化来抑制CDH1的表达,从而推动GBC细胞的EMT过程。
研究者下一步假设YAP因子与GBC中的DNMT3A表达相关,利用PCR阵列对去除了DNMT3A 的 GBC 细胞和对照组细胞进行肿瘤转移相关基因表达谱分析。结果表明,DNMT3A耗竭改变最多的失调基因是共转录因子YAP/TAZ的下游靶标(图a),它们在DNMT3A耗竭细胞中的表达变化与YAP耗竭在GBC细胞中的变化高度一致。其他研究结果共同表明DNMT3A与YAP/TAZ合作,在GBC中产生侵袭行为。
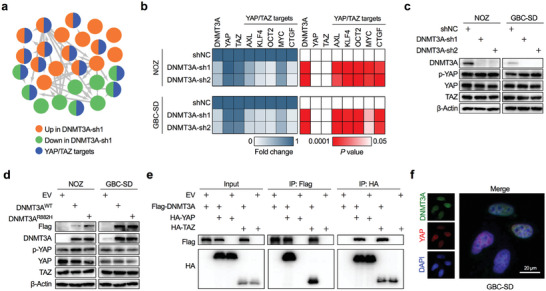
基于PCR阵列的肿瘤转移相关基因分析表明,YAP/TAZ转录靶标在去除了DNMT3A的细胞和对照组NOZ细胞中的表达不同。
之后研究者探究到DNMT3A和YAP/TAZ可通过YAP/TAZ招募DNMT3A结合到CDH1启动子并催化CDH1启动子中CGI的超甲基化,从而在功能上相互作用抑制CDH1的转录,而且YAP/TAZ是DNMT3A识别启动子上特定CGI的必要条件。总的而言,DNMT3A需要YAP/TAZ来识别、访问CDH1启动子并使其超甲基化,从而加速EMT进程,推动GBC转移







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


