本周为大家带来的文献为发表于Theranostics. (IF:12.4)上的《Integrin αvβ3-targeted radionuclide therapy combined with immune checkpoint blockade immunotherapy synergistically enhances anti-tumor efficacy》。本文使用了LabEx提供的Luminex检测服务。
本文探讨了联合使用放射性核素治疗(TRT)和免疫检查点阻断疗法(ICB)对提高抗肿瘤疗效的可能性。在这项研究中,研究人员提出了一种新疗法,即在小鼠结肠癌模型中结合使用基于程序性死亡配体1(PD-L1)的免疫疗法和基于肽的TRT(以177Lu为放射性核素)。通过探索在放射性核素治疗后给予抗PD-L1抗体(αPD-L1 mAb)的最佳时机,研究发现TRT会导致T细胞上PD-L1表达的急性增加,而TRT与αPD-L1 mAb的结合刺激了CD8+ T细胞的浸润,从而提高了局部肿瘤控制、总生存期和对肿瘤再挑战的保护。此外,数据揭示这种联合疗法的时间窗口可能对结果至关重要。总之,这种治疗方法可能是治疗TRT可以使用的转移性肿瘤的一种有前景的方法。临床转化结果表明,与TRT结合使用时,同时而不是顺序地阻断PD-1/PD-L1轴可以提高总生存期和长期肿瘤控制。该研究主要探讨了两种放射治疗形式——外照射放疗和靶向放射性核素治疗(TRT)的区别,并提出了将TRT与免疫疗法相结合的新治疗方案。
LabEx提供的组化检测服务:
对所有五组(A-E)切除的肿瘤进行 CD31 染色以评估肿瘤血管,Ki-67 染色以评估肿瘤增殖,TUNEL 染色以确定 DNA 损伤。在有大面积坏死的 D 组和 E 组中,我们对肿瘤边缘的活细胞进行了评估。如图5、5所示,D组(同时使用177Lu-EB-RGD和抗PD-L1 mAbs治疗)的肿瘤血管范围是所有组中最小的。此外,在A、B和C组中,Ki-67 阳性染色的细胞比例相对较高,而在D组和E组中,细胞增殖明显减少。血红素和伊红染色显示(LabEx提供的服务),D组的大部分肿瘤区域在初始治疗 7 天后已经坏死,而其他四组的肿瘤仅在肿瘤中部有坏死区域,这表明坏死是由于供血不足和缺氧造成的。
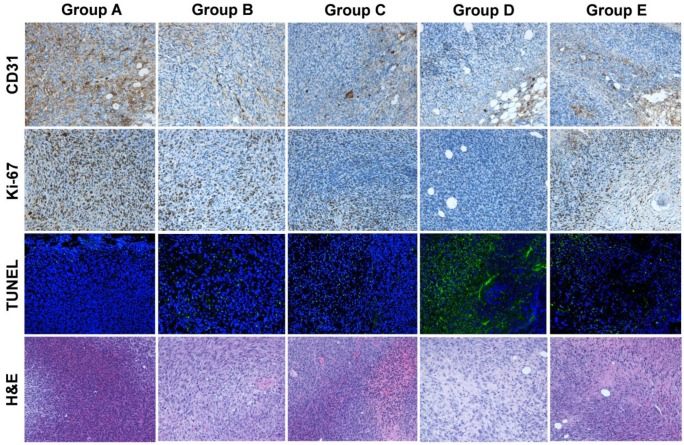
用生理盐水(A 组)治疗后,切除肿瘤的 CD31(血管)、Ki-67(增殖)、TUNEL(凋亡)以及苏木精和伊红(H&E)免疫荧光染色、 177Lu-EB-RGD(B组)、αPD-L1 mAb(C组)、177Lu-EB-RGD和αPD-L1 mAb同时联合治疗(D组)以及177Lu-EB-RGD和αPD-L1 mAb连续联合治疗(E组)。A-D组的肿瘤样本在治疗后第7天采集,E组的样本在治疗后第14天采集(αPD-L1 mAb从TRT第11天开始)。
主要发现:
- PD-1/PD-L1轴阻断在肿瘤治疗中表现出潜力,但需要与放疗等组合以提高效果。
- TRT联合PD-L1阻断可改善肿瘤治疗效果,可能通过激活肿瘤微环境的免疫反应实现。
- TRT后PD-L1表达上调,联合PD-L1阻断可增加CD8+ T细胞浸润,促进肿瘤控制。
- 同时进行TRT和PD-L1阻断比顺序治疗更有效,时间窗口关键。
- 早期的PD-L1阻断可能有助于产生持久的抗肿瘤免疫记忆。
- TRT可能通过激活肿瘤微环境的免疫反应,提高肿瘤对治疗的敏感性。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


