【空间多组学应用系列课堂】
空间多组学技术在脑肿瘤研究中的应用案例汇总
脑肿瘤发病率约占全身肿瘤的2.5%,排在肿瘤发病率的第十位,其中胶质瘤(Glioma)是起源于神经系统胶质细胞的肿瘤,是颅内最常见的原发性恶性肿瘤,约占颅内肿瘤的40%-50%。而脑转移瘤是最常见的继发性颅内恶性肿瘤,占颅内肿瘤的10%-15%。脑转移也是肿瘤患者远处转移的常见部位,其中肺癌占所有脑转移的50%左右。
大脑复杂的功能结构和组织微环境给脑肿瘤研究带来了一些挑战,包括血脑屏障、独特的免疫环境、复杂的细胞-细胞相互作用网络和特定的代谢限制等。GeoMx® DSP空间多组学技术结合了组织影像分析和原位定量技术,可在展示全局组织形态结构的基础上,进一步实现对不同位置感兴趣区域(ROI)中的全转录组(~20000个基因)和蛋白组(~570种蛋白质)表达进行原位检测分析,便于深入剖析肿瘤发生发展中肿瘤微环境异质性。
《Clinical Cancer Research》
CXCL14促进神经胶质瘤中脑肿瘤相关免疫反应

Kumar A, Mohamed E, Tong S, Chen K, Mukherjee J, Lim Y, Wong CM, Boosalis Z, Shai A, Pieper RO, Gupta N, Perry A, Bollen AW, Molinaro AM, Solomon DA, Shieh JTC, Phillips JJ. CXCL14 Promotes a Robust Brain Tumor-Associated Immune Response in Glioma.Clin Cancer Res. 2022 Jul 1;28(13):2898-2910. doi: 10.1158/1078-0432.CCR-21-2830. PMID: 35511927; PMCID: PMC9250623.
研究样本:89例II-IV级星形细胞瘤病,其中27例为多形性黄色星形细胞瘤(PXA),32例为IDH突变型星形细胞瘤,30例为IDH野生型胶质母细胞瘤(GBM);
检测方法:GeoMx® DSP空间蛋白组、多重免疫荧光(mIF)、nCounter PanCancer Immune Profiling;
GeoMx® DSP形态学标记:小胶质细胞:IBA1;淋巴细胞:CD3;细胞核:DAPI;
ROI圈选:T细胞富集区;
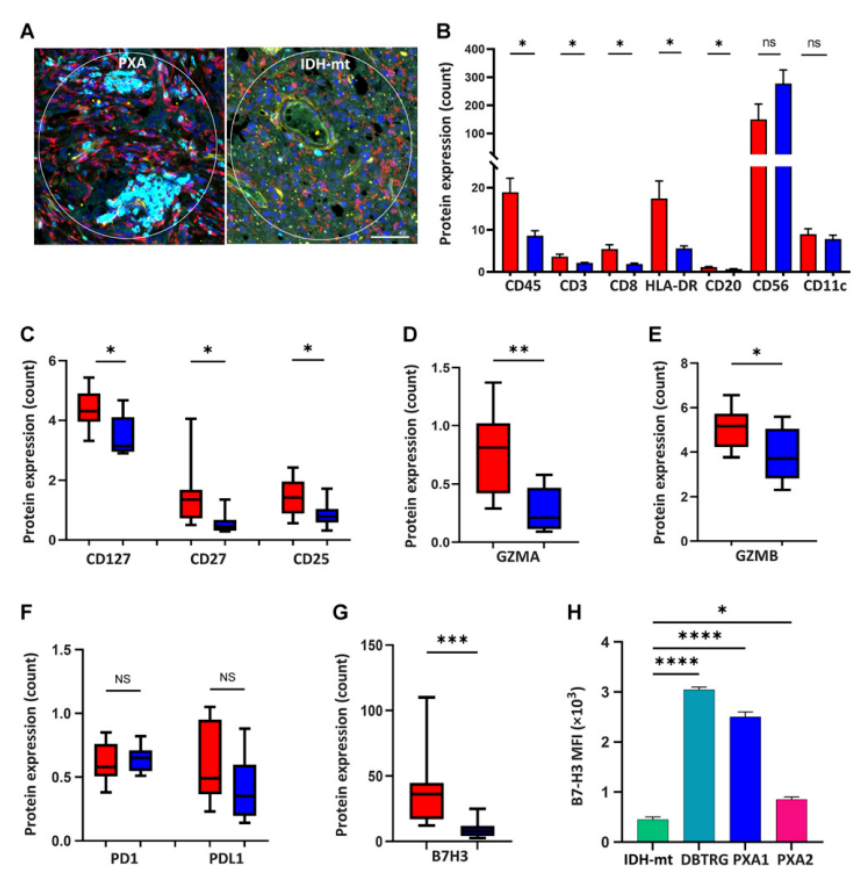
研究发现:利用GeoMx® DSP对PXA(n = 46)和IDH-mt星形细胞瘤(n = 9)队列中的8种免疫反应相关蛋白进行了空间表达分析。通过对CD3+ T细胞富集区域的分析揭示了肿瘤相关免疫应答蛋白的定量和定性差异;PXA显示整体CD45+免疫细胞、CD3+ T细胞、CD8+ T细胞、HLA-DR抗原呈递细胞和CD20+ B细胞增加;T淋巴细胞活化和免疫功能由CD25、CD27和CD127等共刺激分子调节,相对于IDH-mt星形细胞瘤,这些共刺激分子中的每一个在PXA中均显着增加;并且与IDH-mt星形细胞瘤相比,PXA中CXCL4也显著升高。
研究总结:研究确定MAPK激活的低级别星形细胞瘤PXA具有富含免疫力的肿瘤微环境,并表明该肿瘤可能特别容易受到免疫治疗调节的影响。研究进一步确定CXCL14是胶质瘤相关免疫微环境的重要决定因素,可以促进抗肿瘤CD8+ T细胞反应。
《Neuro-Oncology Advances》
GeoMx® DSP空间多组学技术联合CosMx™ SMI原位技术多维度揭示脑胶质瘤空间异质性

Joel J D Moffet, Oluwaseun E Fatunla, Lutz Freytag, Jurgen Kriel, Jordan J Jones, Samuel J Roberts-Thomson, Anna Pavenko, David K Scoville, Liang Zhang, Yan Liang, Andrew P Morokoff, James R Whittle, Saskia Freytag, Sarah A Best, Spatial architecture of high-grade glioma reveals tumor heterogeneity within distinct domains, Neuro-Oncology Advances, 2023;, vdad142, https://doi.org/10.1093/noajnl/vdad142
研究样本:3例IDH1-野生型胶质母细胞瘤(GBM),3例IDH1-突变星形细胞瘤(A, Astrocytoma)用于GeoMx® DSP空间转录检测;其中一例GBM进行CosMx™ SMI检测;
检测方法:GeoMx® DSP空间全转录组、CosMx™ SMI单细胞空间原位成像分析;
GeoMx® DSP形态学标记:Ki67标记增殖肿瘤细胞、CD45标记免疫细胞、GFAP标记脑细胞、SYTO13标记细胞核;
ROI圈选:根据细胞类型分为肿瘤细胞、增殖肿瘤细胞、免疫细胞,根据空间位置分为浸润肿瘤(IT)和前缘(LE)肿瘤中心(CT);

研究发现:利用GeoMx® DSP对每个ROI进行空间全转录组表达谱检测分析,揭示不同区域肿瘤组织和微环境的空间异质性。与间充质肿瘤和祖细胞肿瘤群体中的星形细胞瘤相比,GBM样本中的肿瘤内异质性显著增加。此外,针对一例GBM进行CosMx™ SMI组织原位分子成像检测,共检测了11801个细胞并鉴定出35个类群。为了更好地表征肿瘤细胞空间表型,研究者根据五个细胞系,对肿瘤细胞进行重新聚类和重新标记,并发现间充质细胞富集区与星形细胞和祖细胞富集区非常接近,与GeoMx® DSP分析的空间异质性程度相似。通过CosMx™ SMI的配-受体分析发现,GBM微环境部分由亚型特异性配-受体信号决定,进而调控肿瘤与免疫细胞相互作用。
研究总结:通过GeoMx® DSP空间全转录组联合CosMx™ SMI单细胞空间原位成像分析技术,从不同维度揭示了脑胶质瘤空间异质性。CosMx™ SMI技术的应用对于GeoMx® DSP结果进行了深度验证和进一步补充丰富。通过多种空间生物学前沿新技术,该研究深度揭示了高级别胶质瘤和星形细胞瘤不同的免疫微环境组成。
《Nature Communications》
非小细胞肺癌脑转移的空间转录组学景观

Zhang, Q., Abdo, R., Iosef, C. et al. The spatial transcriptomic landscape of non-small cell lung cancer brain metastasis.Nat Commun 13, 5983 (2022). https://doi.org/10.1038/s41467-022-33365-y
研究样本:44例脑转移非小细胞肺癌(NSCLC)患者,制作了每位患者包含原发性肺癌组织(L)、转移性淋巴结(mLN)、脑转移组织(LB)、肿瘤邻近脑组织(TBME)的组织芯片,同时TMA还纳入了7名无脑肿瘤患者的脑组织样本做为对照(BC);
检测方法:GeoMx® DSP空间转录组、TCGA LUAD数据库;
GeoMx® DSP形态学标记:panCK标记NSCLC肿瘤细胞、CD45标记免疫细胞、GFAP标记脑细胞、SYTO83标记细胞核;
ROI圈选:119个ROIs(Regions-of-interest)、检测18694个基因的表达;
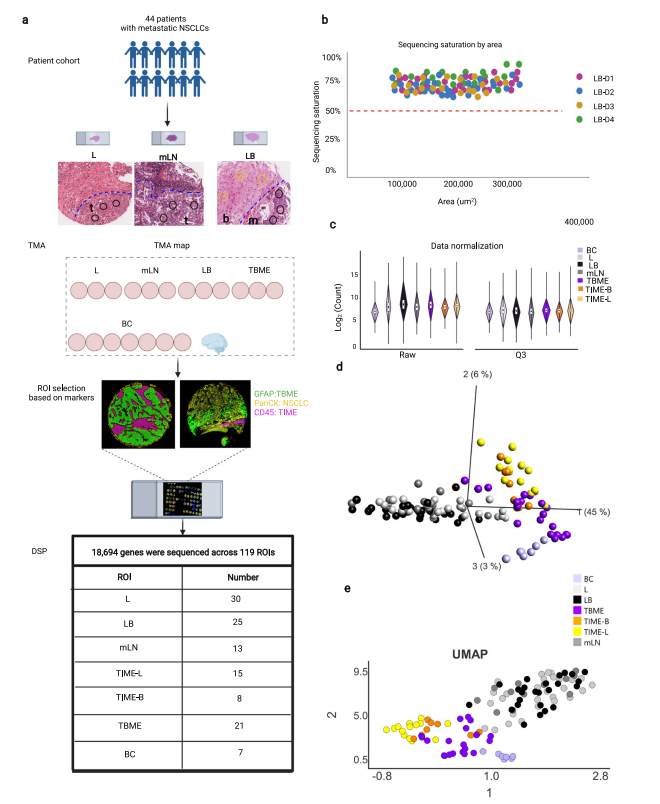
研究发现:研究结果提示,与原发肿瘤免疫微环境(TIME-L)相比,脑肿瘤免疫微环境(TIME-B)中发现T细胞、B细胞的激活、细胞因子和趋化因子的信号传导减少。研究表明T细胞和B细胞/抗体介导的适应性免疫反应在脑转移环境中受到损害或抑制。同时研究在原发肿瘤(即TIME-L)和 BrMs(即TIME-B 和TBME)的TME中发现了大量的成纤维细胞(CAF),这说明癌症相关成纤维细胞(CAF)和肿瘤间质在脑转移中的重要性。进一步分析比较肿瘤核心区和TME区pEMT基因的表达水平发现,肿瘤核心区表达水平明显升高,表明肿瘤内pEMT基因的表达升高与NSCLC脑转移有关。最后对转移的特征基因分析发现,TIMP-1单独或与CTSB一起在脑肿瘤微环境中的表达下降与患者的生存率呈负相关。
研究总结:此研究利用GeoMx® DSP空间转录组技术对44例患者原发灶和转移灶(脑转移和淋巴结转移)不同区域进行了转录组研究,阐明了NSCLS转移灶(特别是脑转移)和原发灶之间的微环境异质性,并进一步解析了NSCLC转移机制,也发现颅内的肿瘤微环境(TME)的广泛重塑。同时也发掘并验证了和预后相关的转移的特征基因。
《Acta Neuropathologica Communications》
肺腺癌脑转移和乳腺癌脑转移肿瘤特异性免疫特征谱

Najjary S, Kros JM, de Koning W, Vadgama D, Lila K, Wolf J, Mustafa DAM. Tumor lineage-specific immune response in brain metastatic disease: opportunities for targeted immunotherapy regimen?Acta Neuropathol Commun. 2023 Apr 15;11(1):64. doi: 10.1186/s40478-023-01542-9. PMID: 37061716; PMCID: PMC10105417.
研究样本:11例肺腺癌脑转移(BM-LUAD)、11例乳腺癌脑转移(BCBM);
检测方法:GeoMx® DSP空间蛋白组、nCounter PanCancer IO 360™ Panel、多重免疫组化(mIHC);
GeoMx® DSP形态学标记:panCK标记肿瘤细胞、CD45标记免疫细胞、DAPI标记细胞核;
ROI圈选:panCK+区、CD45+区;
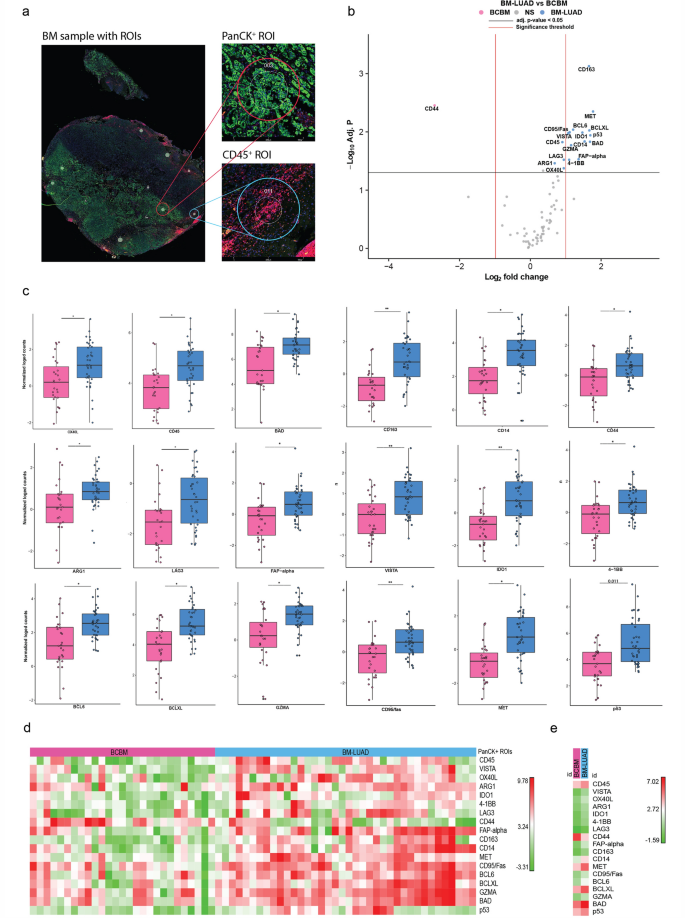
研究发现:研究通过nCounter PanCancer IO 360™ Panel检测发现BM-LUAD中的免疫反应比BCBM更活跃。与BCBM相比,在BM-LUAD138个基因上调此外,与CD45+细胞、T细胞和细胞毒性T细胞相关的基因在BM-LUAD中的表达高于BCBM。使用GeoMx® DSP空间蛋白组分析进一步揭示,与BCBM相比,BM-LUAD的肿瘤区域中CD14和CD163表达更高。更为重要的是,免疫检查点VISTA和IDO 1在BM-LUAD中高度表达。
研究总结:此研究利用nCounter和GeoMx® DSP技术对肺腺癌脑转移和乳腺癌脑转移组织进行检测和分析,与BCBM相比,BM-LUAD是具有更多免疫细胞分布、更多的活化途径以及免疫检查点分子VISTA和IDO 1的显著表达的高度免疫原性肿瘤。因此,BM-LUAD是一种免疫学上的“热”肿瘤,为未来治疗策略提供了一定参考。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


