肿瘤浸润性淋巴细胞(TIL)治疗的全部潜力一直受阻于TILs的不充分激活和低持久性,以及肿瘤的低效新抗原呈现。发表于《Molecular therapy》的论文“An armed oncolytic virus enhances the efficacy of tumor-infiltrating lymphocyte therapy by converting tumors to artificial antigen-presenting cells in situ”中,研究者将OX40L和IL12编码进基于单纯疱疹病毒1(HSV-1)的瘤病毒,感染肿瘤细胞后,可以将其转化为人工抗原呈递细胞(aAPCs),并且提供最佳T细胞激活的局部信号。这种联合疗法展现出治疗肿瘤的潜力。该研究使用了LabEx提供的Luminex多因子检测服务(Mouse Cytokine 23-plex),检测了23种因子的表达。

接下来就一起看看该文章如何一步步研究出具有潜力的肿瘤治疗模型。
研究者在ICP34.5和ICP47双删减的溶瘤HSV-1的骨架上产生了一个共同表达免疫刺激分子IL12和膜拴住的OX40L的溶瘤HSV-1(图1A)。还产生了表达三聚体OX40L、IL12或GFP的重组OVs(图1B)。通过流式细胞术,ELISA和荧光素酶报告证实了该模型成功表达OX40L和IL12,并确保其生物活性(图1C、D、E、F)。

验证了OVs成功构建后,研究者通过共培养口腔癌患者的肿瘤细胞和TILs,监测表型来评估OVs是否成功地将肿瘤细胞转化为aAPCs。免疫表型通过RT-PCR和流式细胞术反映(图2A,B)。OVs有效促进了HLA-A/B/C和HLA-DR/DP/DQ,不同程度地增加了肿瘤细胞上适配受体CD80和CD86的表达。共培养时,肿瘤细胞上程序性死亡配体1(PD-L1)的表达也增加,OV-OX40L-、OV-IL12-或OV-OX40L/IL12感染的肿瘤细胞刺激了T细胞增殖。分泌IFN-γ(T细胞激活的指标)的细胞数量也明显增加(图2D、2E)。TILs的细胞毒性由肿瘤细胞的存活率反映,结果为其活力显著下降(图2G)。

OV-OX40L/IL12和自体TILs的联合免疫治疗导致PDX模型的肿瘤消退
研究者继续在口腔癌PDX模型中评估此组合疗法的体内抗肿瘤活性。PDX小鼠模型被施以OV-Δ34.5或OV-OX40L/IL12的单次瘤内注射,2天后再进行自体TILs的瘤内注射(图3A)。组合疗法诱发了完全或几乎完全的肿瘤消退,增加肿瘤内IFN-γ水平。

OV-MOX40L/IL12和TILs的联合治疗导致了免疫功能正常的小鼠肿瘤模型的明显肿瘤消退和长期免疫记忆
通过使用携带皮下植入的结直肠 MC38 肿瘤的小鼠测试联合疗法在同源肿瘤模型中的抗肿瘤活性。OV-mOX40L/IL12 和 MC38 TIL 的组合引起小鼠肿瘤完全消退,并且在治疗后 180 天内仍保持无肿瘤状态(图4B、C)。 图4D、E中,对肿瘤治愈小鼠未治疗的一侧再次挑战,导致所有年龄匹配的肿瘤幼稚对照小鼠都发展了肿瘤,代表长期免疫记忆的发展。值得注意的是,联合疗法几乎完全控制了已治疗和远端未治疗的肿瘤(图 4F和 4G),表明它引发了全身性抗肿瘤作用。

使用联合疗法后,肿瘤细胞中的MHC I、MHC II、共刺激配体(CD86 和 OX40L)和 IL12 的表达皆显著性增加,表明肿瘤已成功转化细胞转化为 APC 样细胞(图5A)。图5B使用了流式细胞术检测了肿瘤细胞中APC相关的分子。

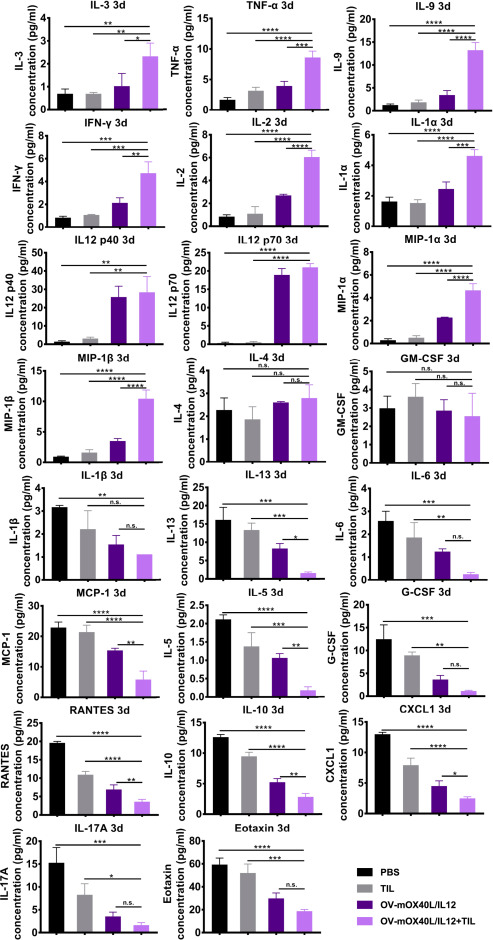
在day3和day7分析了血清中的细胞因子的表达量,检测了小鼠23个细胞因子(由LabEx提供支持),发现了IL12、IFN-γ、IL2 和 TNF-α等与免疫反应密切相关的细胞因子水平增加。而IL5、IL10、IL13 和 IL6水平降低,它们通常参与肿瘤生长、转移扩散和肿瘤逃避免疫监视。这些结论表明此疗法会引发全身的免疫反应。
肿瘤来源的 aAPCs 引发幼稚 T 细胞反应
为了确认是否肿瘤来源的aAPC可以激活幼稚T细胞,研究者使用流式细胞术和ELISpot分析T细胞表型和激活状态。细胞溶解活性,IFN-γ 产生,初始 OT-I 和 OT-II T 细胞分化为记忆和效应 T 细胞等事件均说明幼稚T细胞反应被启动。

该篇文章研究了一种结合OV-OX40L/IL12和TIL的联合疗法,发现在患者衍生的异种移植和同步小鼠肿瘤模型中诱发了完全的肿瘤消退,并激发了抗肿瘤免疫记忆。此外,联合治疗在肿瘤细胞中产生了aAPC特性,激活了T细胞,并将巨噬细胞重新编程为肿瘤微环境中更像M1的表型。这种组合值得在临床研究中进一步评估。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


