综述背景
动脉粥样硬化是心血管疾病的主要病因之一,其研究机制对预防和治疗心血管疾病尤为重要。动脉炎症作为动脉粥样硬化的标志,但仍未明确如何管理和缓解它。这篇综述回顾了免疫细胞在动脉粥样硬化中如何激活、影响疾病进展以及其背后的细胞因子回路。讨论了这些机制在免疫疗法治疗心血管疾病中的应用。
一、免疫细胞对动脉粥样硬化的影响?
动脉粥样硬化的关键病因之一是胆固醇处理的过负荷或者缺陷,免疫细胞在心血管疾病中的作用往往与这相关。很多细胞类型和表型在斑块中被发现,包括:淋巴细胞、树突状细胞、特异性T细胞(Th1/Th17)、调节性T细胞、B淋巴细胞、平滑肌细胞等等。
其中单核吞噬细胞经常在斑块中被发现。传统的假设是单核吞噬细胞首先获取、积累胆固醇、再亲自将胆固醇输入到动脉壁。这些吞噬细胞会驻留在血管中,很容易被酯化并储存在细胞质脂滴中。这种细胞状态被称为泡沫细胞,常被认为与早期动脉粥样硬化密切相关。这会引起游离胆固醇水平过量,驱动信号变化和细胞毒性。但最新的假设提出,疾病早期生成的胆固醇晶体会激活炎症小体,引起IL-1β的增加。这个假设受到了临床证据的支持:炎症因子的mRNA的表达没能在胆固醇斑块中的泡沫细胞里发现,而发现在斑块内的CCR2+非泡状巨噬细胞,疑似新招募的单核细胞中。
在斑块中,单核细胞会经历一个高度炎症的过渡阶段,并在这期间分化。图2展示了在结肠炎中巨噬细胞的转化,强调了单核细胞分化为组织常驻巨噬细胞的中间阶段要经过一个短暂的促炎阶段。此外,除了单核细胞招募增加泡沫细胞池外,斑块巨噬细胞也可能通过增殖而扩大。
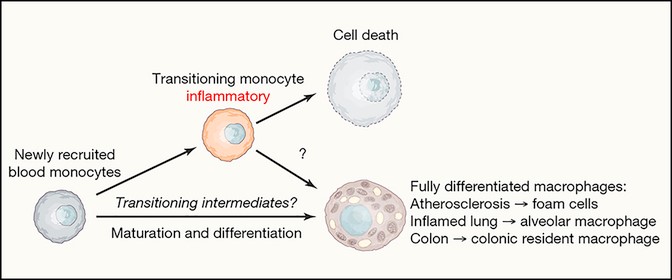
即使先前的假设中提出了泡沫细胞不是细胞因子的源头,但这并不代表它们没有间接促进斑块或者炎症的进展。这些细胞的凋亡或坏死与疾病进展密切关联。细胞的凋亡在正常情况下并非炎症过程,但如果死细胞无法被吞噬作用清除,便会在斑块中逐渐积累,形成坏死核心。这个部分的扩张很不稳定,有可能增加临床上斑块破裂的概率。另一种可能是来自泡沫细胞的坏死碎片和累积的DAMPs和细胞外胆固醇晶体,与斑块中发现的非泡沫CCR2+ IL-1β+巨噬细胞的招募和激活有关。
二、从实验室到临床——IL-1β的作用
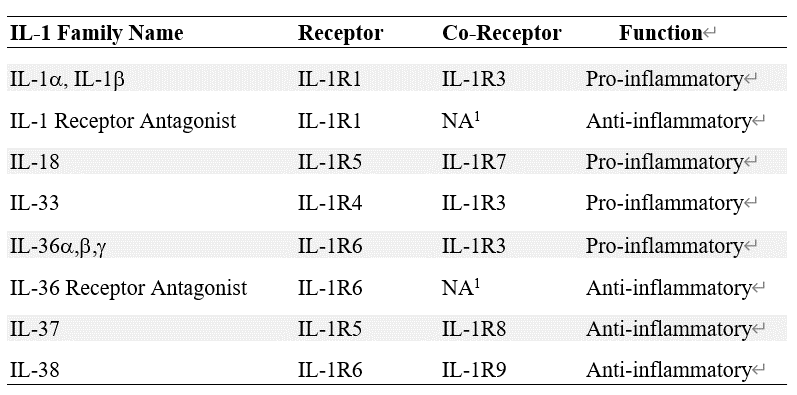
白细胞介素1是一种作用繁多的炎症介质。它和TNF一起作为内皮细胞激活的中心调节器。通过激活NFkB,反过来又使粘附分子和螯合剂上调,IL-1协调炎症细胞招募到炎症部位,这种活动与动脉硬化特别相关。IL-1家族的成员与许多炎症性和发育性疾病有广泛联系。除了IL-1的两个主要成分IL-1α和IL1β,还包括IL-18、IL-33、IL-36α、IL-36β、IL-36γ、IL-37和IL-38。
IL-1β在细胞质中以非活性前肽的形式产生,激活需要裂解分子的原型。这种裂解可以在细胞内或细胞外发生。IL-1β通常由caspase-1裂解,一种细胞内半胱氨酸蛋白酶(图3)。炎症体可以在各种细胞中激活,包括内皮细胞,但在巨噬细胞中特别相关。下游的任何一个分子都可以刺激表达,包括识别微生物、结合细胞外ATP、缺氧和吞噬不可降解颗粒。
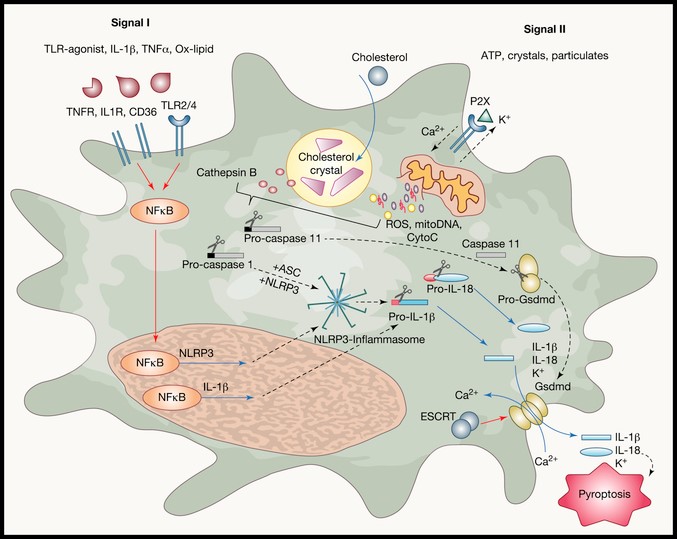
动脉硬化的系统调节剂(红色为加重心血管疾病的不利信号,蓝色为抑制心血管疾病的机制)
图3展示了多种系统调节剂在动脉粥样硬化中的作用机制,其中红色表示加重心血管疾病的不利信号,而蓝色为抑制心血管疾病的机制。炎症小体通过两种典型通路激活,参与IL-1β和IL-18的产生与激活。这两个细胞因子再通过Gsdmd蛋白介导的孔隙释放,引起K+的流失和Ca2+离子的进入,最终导致细胞坏死。但这个途径是否导致细胞死亡,或者细胞是否能够释放IL-1β并在组织中持续存在,仍旧存在争议性。最近的研究表明,ESCRT可以控制Gsdmd介导的孔隙形成参与膜的修复,从而减少细胞死亡。
多种研究证据表明,IL-1β的减少会缓解斑块负担和内皮激活,反之,它的水平上升会增加动脉粥样硬化的进展。同样,有证据表明IL-1Β和炎症小体可以增加冠心病的风险。已经有临床试验使用可以中和IL-1Β的人源单克隆抗体canakinumab治疗有过心肌梗塞经历和高水平CRP的高风险心血管疾病患者。这种IL-1β靶向疗法有效地减少了循环细胞因子IL-6和CRP,与胆固醇的任何变化无关。另一种药物CANTOS指出可以通过缓解炎症来减少临床上严重的心血管疾病。但是靶向IL-1β也会具有一定的风险,例如致命的感染反而使得试验最后的总死亡率没有改变。即便IL-1β抑制剂是一种有希望的疗法,但仍然有更多的问题需要解决。
我们已经讨论了动脉粥样硬化本地的疾病情况,但依旧有很多全身的系统调节剂。这些包括广为人知的一些风险因素:吸烟、饮食、不规律生活、环境因素等等。其中,饮食会影响肠道的微生物组,在正确的底物出现时,促进促动脉粥样硬化的代谢物TMAO生成。此外,正常的睡眠循环,温暖的环境都可以降低心血管疾病的风险。

越来越多的全身性系统调节剂从机理上影响了骨髓对骨髓细胞的生成。血液中的中性粒细胞和单核细胞数也被发现是心血管疾病的风险因素之一。
自身免疫是另一类影响心血管疾病风险的因素。类风湿性关节炎、银屑病、克罗恩氏病、一型糖尿病等自身免疫性疾病都会增加心血管疾病的风险。研究者提出在自身免疫反应部位产生的循环细胞因子被制造得足够丰富,溢出到循环中,然后作用于容易发生动脉粥样硬化的远端动脉,促进血管细胞活化和功能障碍。这种假设被称为细胞因子溢出。拿银屑病举例,首先很明确的是银屑病中的血管变化。此外最近的转录分析显示,有证据表明静脉内皮被激活以表达粘附分子和趋化因子,以及循环白细胞表达IL-1β mRNA和其他细胞因子。循环TNF和IL-17也在银屑病中记载过。
部分证据也质疑了细胞因子溢出模型的可靠性。首先,这种变化与细胞因子释放的幅度相关,是一个比存在自身抗体更低的心血管事件的风险因素。此外,在人类受试者和银屑病小鼠模型中出现的一个与使用IL-23靶向治疗有关的特殊观察,很难在细胞因子溢出的概念中得到解释。
原文链接:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6924925/







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


