Mechanical Unloading Promotes Osteoclastic Differentiation and Bone Resorption by Modulating the MSC Secretome to Favor Inflammation
MSCs; bone resorption,骨吸收, inflammation,炎症, mechanical loading,机械负荷, osteoclasts,破骨细胞 LabEX支持文献- Cell Transplant
- 2024
- 3.2
- 2024 Jan-Dec:33:9636897241236584
- Mouse, Rat
- Luminex
- 生物标志物
- BM-Fluid
- 生物标志物
- 其它细胞
- 骨质流失
- Eotaxin/CCL11,G-CSF,GM-CSF,IFN-γ,IL-10,IL-12(p40),IL-12(p70),IL-13,IL-17A,IL-1α,IL-1β,IL-2,IL-3,IL-4,IL-5,IL-6,IL-9,GRO-α (Gro-a/KC/CXCL1),MCP-1/CCL2,MIP-1α/CCL3,MIP-1β,RANTES,TNF-α
- 10.1177/09636897241236584
相关货号
Abstract
Aging, space flight, and prolonged bed rest have all been linked to bone loss, and no effective treatments are clinically available at present. Here, with the rodent hindlimb unloading (HU) model, we report that the bone marrow (BM) microenvironment was significantly altered, with an increased number of myeloid cells and elevated inflammatory cytokines. In such inflammatory BM, the osteoclast-mediated bone resorption was greatly enhanced, leading to a shifted bone remodeling balance that ultimately ends up with disuse-induced osteoporosis. Using Piezo1 conditional knockout (KO) mice (Piezo1fl/fl;LepRCre), we proved that lack of mechanical stimuli on LepR+mesenchymal stem cells (MSCs) is the main reason for the pathological BM inflammation. Mechanically, the secretome of MSCs was regulated by mechanical stimuli. Inadequate mechanical load leads to increased production of inflammatory cytokines, such as interleukin (IL)-1α, IL-6, macrophage colony-stimulating factor 1 (M-CSF-1), and so on, which promotes monocyte proliferation and osteoclastic differentiation. Interestingly, transplantation of 10% cyclic mechanical stretch (CMS)-treated MSCs into HU animals significantly alleviated the BM microenvironment and rebalanced bone remodeling. In summary, our research revealed a new mechanism underlying mechanical unloading-induced bone loss and suggested a novel stem cell-based therapy to potentially prevent disuse-induced osteoporosis.
LabEx Luminex平台助力探索基于干细胞的预防废用性骨质疏松症新疗法
本周为大家带来的文献为发表Cell Transplant. (IF: 3.2)的” Mechanical Unloading Promotes Osteoclastic Differentiation and Bone Resorption by Modulating the MSC Secretome to Favor Inflammation”。本文使用了LabEx提供的Luminex检测服务。
成年个体中存在骨重建的动态平衡,这意味着破骨细胞吸收的骨骼由成骨细胞介导的新骨形成所补充,以确保骨质量和机械强度。该平衡通过精确的耦合机制维持,例如转化生长因子(TGF)-β1引导骨髓(BM)间充质干细胞(MSCs)向吸收的骨表面迁移。许多外部因素,如激素水平、神经信号和机械信号调节耦合过程。长期以来,人们认识到骨组织可以根据机械应力重建形态结构和强度以适应机械负荷。过度的机械刺激促进成骨细胞分化和骨形成。然而,在病理条件下,如长期卧床和衰老,机械负荷减少导致耦合过程失调,增强了骨吸收并同时抑制了骨形成。在这些情况下,骨形成与骨吸收的解耦机制对于临床预防和治疗废用性骨质流失至关重要。
为了解决上述问题,有必要考虑骨组织如何感知机械刺激并将其转化为生化信号。嵌入骨基质中的骨细胞被认为是主要的机械传感器,通过分泌细胞因子(如RANKL(核因子κB受体活化因子配体)、硬化蛋白和Wnts)来调节骨重建活动。然而,越来越多的证据表明,几乎所有的骨系细胞,包括MSCs、祖细胞、前成骨细胞和成熟成骨细胞,都是机械敏感的,表明这些细胞也可能在机械力调节的骨重建中发挥作用。近年来,研究发现,机械信号调节的MSCs及其前体细胞的成骨分化是由机械敏感离子通道Piezo1介导的。同时,Piezo1信号还通过调节成骨细胞中的细胞外基质抑制破骨细胞介导的骨吸收。然而,Piezo1传递的机械信号及其在上述细胞类型中的下游效应需要进一步研究。
LabEx提供的Luminex检测服务
BM液制备和细胞因子检测
用0.5 ml PBS将BM从胫骨和股骨中冲洗出来,并以1000 × g离心10分钟以去除BM细胞。之后,再以12000 × g离心10分钟,收集上清液用于细胞因子检测。使用基于Luminex的多重检测(分别使用LXLBM23-1和LXLBR23-1检测小鼠和大鼠的BM液,Univ-Bio. Co/LabEx, 中国)评估BM炎症细胞因子。
与尾悬液模型相比,Luminex技术显示,在 WB 条件下,Piezo1 基因缺陷小鼠的 BM 液中炎症细胞因子的上调更为显著(图D),单核细胞和中性粒细胞计数也有类似的增加。
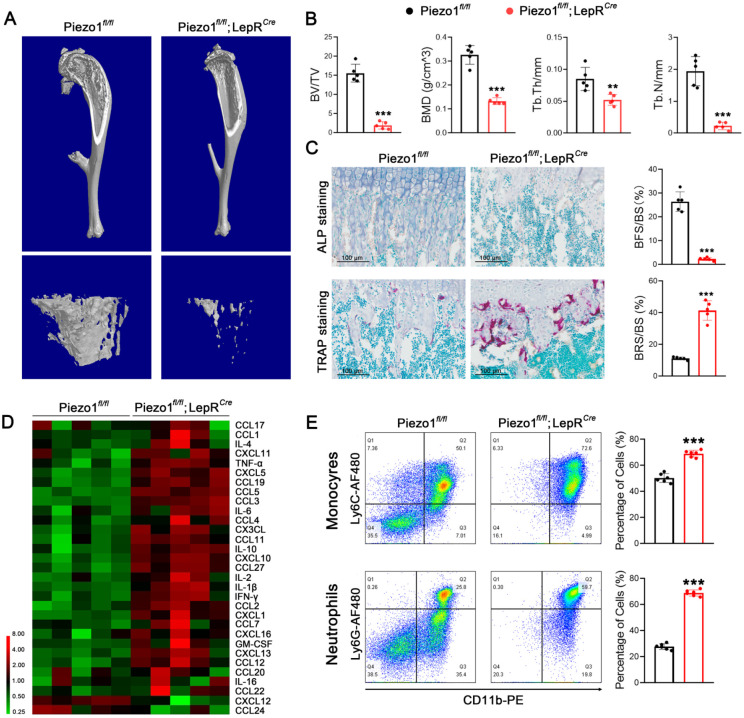
热图显示了 Piezo1fl/fl; LepRCre 小鼠与 Piezo1fl/fl 卵鼠相比,其骨髓液中炎症细胞因子的蛋白水平。
重要发现,
研究者通过使用啮齿动物后肢悬吊(HU)模型发现,骨髓(BM)微环境显著改变,髓样细胞数量增加,炎症细胞因子水平升高。在这种炎症性BM中,破骨细胞介导的骨吸收大大增强,导致骨重建平衡失调,最终导致废用性骨质疏松症。研究者使用Piezo1条件性敲除(KO)小鼠(Piezo1fl/fl;LepRCre),证明了缺乏对LepR+间充质干细胞(MSCs)的机械刺激是引起病理性BM炎症的主要原因。在机械机制上,MSCs的分泌组受机械刺激调节。机械负荷不足导致炎症细胞因子如白介素(IL)-1α、IL-6、巨噬细胞集落刺激因子1(M-CSF-1)等的产生增加,促进了单核细胞增殖和破骨细胞分化。有趣的是,将经10%循环机械拉伸(CMS)处理的MSCs移植到HU动物中,显著改善了BM微环境,并重新平衡了骨重建。总之,研究者的研究揭示了机械卸载引起骨质流失的新机制,并提出了一种基于干细胞的新疗法,可能预防废用性骨质疏松症。
本网站销售的所有产品及服务均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。











 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


