A vaccine targeting mutant IDH1 in newly diagnosed glioma
胶质瘤;疫苗- Nature
- 69.504
- Human
- Luminex
- 神经系统
- 胶质瘤
- G-CSF,GM-CSF,IFN-γ,IL-10,IL-12(p70),IL-13,IL-17A,IL-1β,IL-2,IL-4,IL-5,IL-6,IL-7,IL-8/CXCL8,MCP-1/CCL2,MIP-1β,TNF-α,IL-1Rα,IL-9,IL-15,FGF-basic,Eotaxin/CCL11,IP-10/CXCL10,MIP-1α/CCL3,PDGF-BB,RANTES,VEGF-A
相关货号
Abstract
luminex在疫苗和肿瘤中的应用
一、针对新诊断胶质瘤突变体IDH1的疫苗
突变的异柠檬酸脱氢酶1 (IDH1)定义了一种分子上不同的弥漫性胶质瘤亚型。胶质瘤中最常见的IDH1突变影响密码子132并编码IDH1(R132H),其中包含一个在主要组织相容性复合体(MHC) II类上的共享克隆新表位。IDH1(R132H)特异性肽疫苗(IDH1-vac)诱导特异性治疗性T辅助细胞应答,对同源MHC人源化小鼠IDH1(R132H)+肿瘤有效。
在这里,我们描述了一项多中心、单臂、开放标签、首次在人体内进行的I期临床试验,我们在33名新诊断为世界卫生组织3级和4级IDH1(R132H)+的患者中开展。

1、患者基线和SOC治疗时的特征

2、IDH1-vac安全且具有免疫原性
SDS包括给32名患者接种疫苗。SDS的治疗时间从44天到162天不等(中位数, 155 d),观察时间153 -484 d (平均376天)。质量控制表明,所有疫苗均含300±30 ug肽,无菌,无内毒素。未观察到限制性毒性(RLT)。总的血清细胞因子谱显示了对IDH1-vac的不良细胞因子释放。32例(90.6%)患者发生与治疗相关的不良事件,这些事件均不严重。为了纳入IDH1- ac诱导的特异性T细胞免疫反应的持续时间和水平(R132H),我们建立了一个探究性突变特异性评分,可用的患者样本中IDH1 -vac诱导的外周T细胞的流式细胞术效应子表型MSS显示肿瘤坏死因子(TNF)、干扰素-γ为主,体外再刺激IDH1(R132H)后,T辅助细胞(TH)产生的(IFNγ)和白细胞介素-17 (IL-17)细胞因子,这表明TH1和TH17亚型TH细胞的参与。
IDH1-vac治疗期间血清细胞因子水平(Bio-Plex Pro Human Cytokine 27-plex panel)
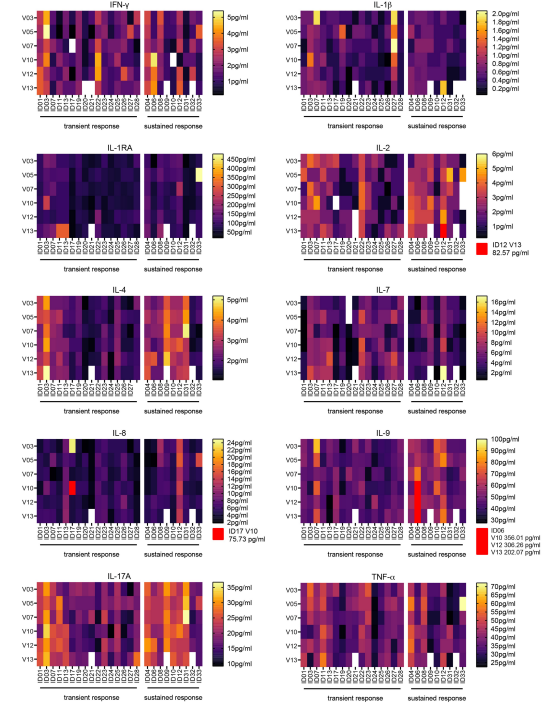
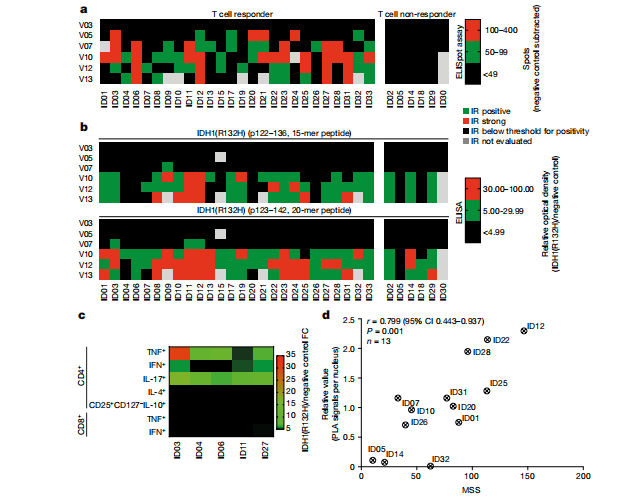
3、IDH1-vac的功效及IDH1特异性T细胞反应和假进展
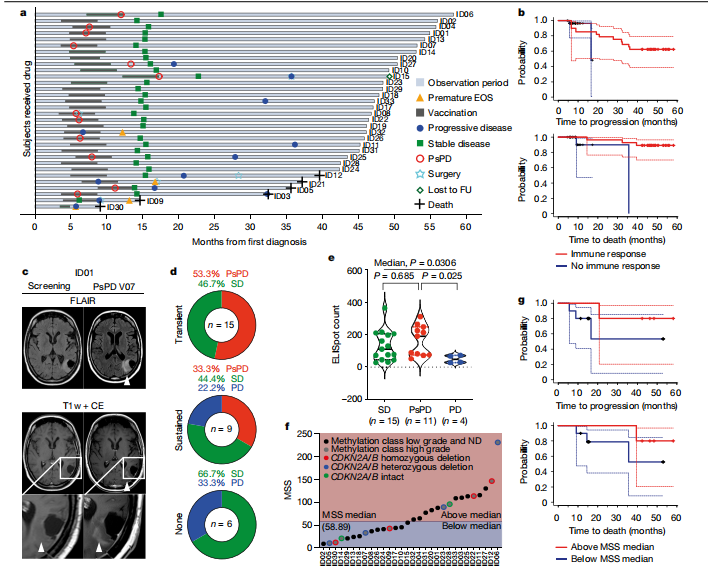
SDS的总有效率为84.4% (95% CI 67.21-94.72%,32例患者中有27例)。在SDS的随访分析中,3年无进展率和无死亡率分别为0.63 (95% CI 0.44-0.77)和0.84 (95% CI 为0.67 - -0.93)。在SDS中,32例患者中有12例发生了假进展(PsPD)。脑成像诊断的对比增强PsPD提示瘤内炎症反应。在NOA16中,PsPD与外周IDH1 -vac诱导的免疫反应的发生相关,并且仅限于有短暂或持续T细胞免疫反应的患者,我们没有在无应答的患者中检测到PsPD 。与进展性疾病患者相比,PsPD患者外周血IDH1-vac诱导的T细胞免疫反应的最大水平更高。
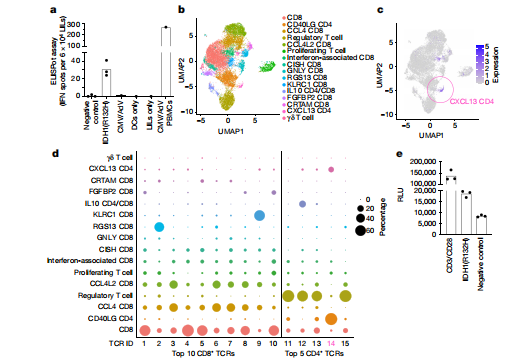
4、参与PsPD中的特异性T细胞受体
TCR缺陷人的转基因TCR表达T细胞系与来自ID08患者的自体抗原提呈细胞共培养显示TCR14对IDH1有反应(R132H)。这些结果表明,IDH1-vac诱导了IDH1(R132H)特异性TH细胞的克隆扩增,并渗透到切除的病变中。
NOA16通过在新诊断的WHO 3级和4级IDH1(R132H)+患者中证明IDH1-vac的安全性和免疫原性达到其主要终点。IDH1-vac的免疫原性(与HLA类型无关)和高的PsPD率值得进一步的临床研究。
二、炎性成纤维细胞介导直肠癌新辅助治疗的耐药性

标准的癌症治疗针对肿瘤细胞,而不考虑可能损害肿瘤微环境的治疗反应。肿瘤微环境(TME)的细胞成分的组成和极化在肿瘤发生中发挥着重要作用,但它们越来越被认为是结合标准细胞毒性治疗的癌症治疗的有吸引力的靶点。放化疗或短疗程放疗为基础的手术切除前新辅助治疗理念的建立成为直肠癌治疗的一个转折点,大幅降低了局部复发率,并在一定程度上提高了生存率。癌症相关的成纤维细胞(CAFs)是TME中最显著和最具可塑性的细胞类型之一,它们由不同来源的细胞群组成,本文说明证明了炎症性CAFs确实是决定直肠癌预后的主要细胞类型,并表明靶向复极化CAFs可以改善治疗反应和长期生存。
在直肠癌原位小鼠模型中,肿瘤细胞来源的IL-1α使CAFs向炎症表型极化,从而导致对照射的抵抗。
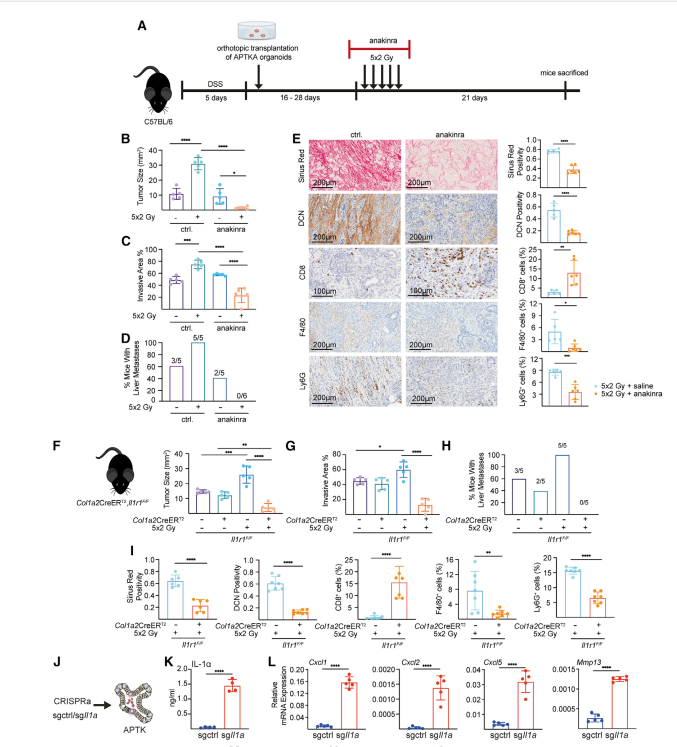
IL-1α信号通路导致亚硝酸盐介导的DNA损伤,诱发炎症性CAFs治疗诱导的衰老;在直肠癌患者中,低水平的IL-1α可增强IL-1信号,使CAFs更易发生治疗性衰老。文章使用Luminex Bio-Plex(Bio-Plex Pro Human Cytokine 27-Plex Assay kit (Bio-Rad))分析法分析血清样本,并测定血清中IL-1α的水平。放化治疗后,non-PCR患者血清IL-1α水平明显降低,表明这些患者具有IL-1信号通路增强的特点。
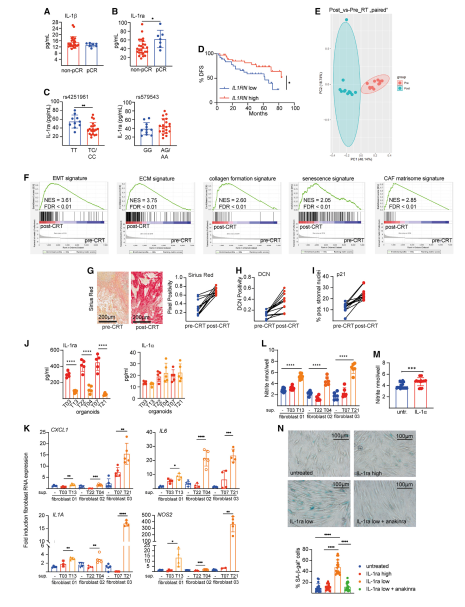
肿瘤细胞与CAFs之间的相互干扰对CRT治疗直肠癌的预后有很大影响,不是肿瘤细胞的突变谱/转录组定义了标准,而是独特的成纤维细胞亚型的极化谱。在文章中,治疗抵抗是由IL-1α依赖性的CAFs极化触发iNOS,继而产生亚硝酸盐,导致DNA损伤,最终导致CAFs的治疗性衰老。
两篇文章中都有用到Bio-Plex Pro™ Human Cytokine 27-Plex Assay kit 及Luminex技术。Bio-Plex Pro™ 基于人细胞因子、趋化因子和生长因子磁性微球检测试剂可检测定量来自多种基质(如血清、血浆和组织培养物上清液)中 53 分析物的水平。细胞因子、趋化因子和生长因子是细胞信号转导蛋白质,这类蛋白质可介导各种生理反应,包括免疫、炎症和造血。 他们与一系列疾病有关,包括肿瘤生长、感染乃至帕金森氏病。这些测试产品基于 6.5 µm 磁性微球,可与真空和磁性自动洗板机兼容。 磁性清洗可简化板处理过程,提供增强的通量,并降低可变性和提高可重复性。
Bio-Plex Pro™液相芯片(luminex)技术
Bio-Plex Pro™ 试剂盒系列产品采用基于独特微磁珠“染色”的液相芯片技术,不同“颜色”微珠偶联单克隆抗体与待检测蛋白,偶联生物素-链霉亲和素-荧光的检测抗体共同形成了”三明治”夹心复合物,只需要 10µl 的样品就能够实现对上百种细胞因子同时检测。
Bio-Plex多重蛋白液相芯片技术特点:
* 小样本:仅需10µl
* 大数据:同时检测多达几十种指标
* 检测灵敏度:0.04pg/ml
* 快速:仅需2-3个小时
* 物种:人、小鼠、大鼠、犬
* 研究领域覆盖:细胞因子、肿瘤、趋化因子、自身免疫性疾病、代谢等。
本网站销售的所有产品及服务均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


