Wheat Amylase Trypsin Inhibitors Aggravate Intestinal Inflammation Associated with Celiac Disease Mediated by Gliadin in BALB/c Mice
Th1/Th2;celiac disease;gliadin;intestinal inflammation;wheat amylase trypsin inhibitors LabEX支持文献- Foods
- 2022
- 11(11):1559.
- 免疫/内分泌
Abstract
小备说文献丨 Luminex助力探索乳糜泻病发病机制
这项研究探讨了乳鼠(BALB/c mice)在摄入麸质的情况下,尤其是小麦淀粉酶胰蛋白酶抑制剂(ATI,非麸质蛋白)和麦麸(gliadin)的影响,同时考察了相关辅助剂(的干预作用。该研究采集了外周淋巴结细胞和肠组织进行炎症分析。结果显示,摄入麦麸和ATI导致小鼠肠道发炎。此外,对四个肠段(十二指肠、空肠、末端回肠和结肠中段)的组织病理学染色显示,辅助剂,特别是聚肌苷:聚胞苷酸,增强了在ATI和麦麸小鼠模型中的绒毛损伤和隐窝增生。免疫组化结果表明,在ATI和麦麸处理的小鼠空肠组织中,组织转谷氨酰胺酶和IL-15表达显著增加。LabEx提供的Luminex检测炎症因子(TNF-α、IL-1β、IL-4、IL-13)的表达结果,以及Th1/Th2细胞平衡的结果也表明,在ATI和麦麸的共同刺激下,炎症反应显著增强。这项研究为小麦淀粉酶胰蛋白酶抑制剂在乳鼠中导致乳糜泻病发病机制方面提供了新的证据。
Introduction
小麦作为全球前三大粮食作物之一,尽管广受赞誉,但一些人在食用基于小麦的产品后产生了负面健康效应,如腹泻病和皮疹性疱疹等形式,与多种小麦蛋白有关。
腹泻病是一种慢性肠道炎症,通常表现为绒毛损伤和腺体增生,其发病机制与人体对小麦麸质的自身免疫反应有关,尤其是其醇溶蛋白酶胰蛋白酶抑制剂(ATI)成分。ATI是小麦面粉中与麸质无关的蛋白质成分,经常被认为是引发小麦过敏和非腹泻病性麸质敏感以及激活先天免疫系统的触发器。
研究者推测ATI可能加剧腹泻病的发病机制,尤其是通过Toll-like receptor 4(TLR4)-MD2-CD14途径诱导肠道内在免疫反应。实验中使用了辅助剂(CT、Poly:IC和DSS)来进一步加剧小鼠肠道炎症。研究的系统评估了ATI、醇溶蛋白和相关辅助剂对BALB/c小鼠肠道炎症的影响,包括临床评分、体温、体重、肠道组织的组织学切片、组织转麦芽胺酶和IL-15的免疫组化分析、Th1/Th2的分化以及脾细胞分泌的炎症因子的表达。
Methods
组织学观察:小鼠的肠道组织(结肠、回肠、空肠和十二指肠)被固定,并嵌入石蜡中,使用苏木精和噻唑红染色对切片进行了组织学检查。
空肠组织切片的免疫组织化学:采用石蜡包埋的空肠组织切片进行了组织转麦芽胺酶(tTG)和IL-15的免疫组织化学(IHC)。使用抗小鼠tTG、抗小鼠IL-15和二抗(HRP标记),定量分析IHC数据。
离体脾细胞培养和细胞因子分析:小鼠脾脏细胞培养后,使用Luminex分析细胞上清液,脾细胞中IL-1β、IL-4、IL-13和TNF-α的水平。
脾细胞的Th1和Th2细胞亚群:根据细胞亚群分泌的特定细胞因子的差异,通过IFN-γ和IL-4的胞内产生水平使用流式细胞仪间接测量Th1和Th2细胞亚群的表达。
Results
在进行了四周的无麸质饮食后,次代雌性小鼠暴露于含有醇溶蛋白酶胰蛋白酶抑制剂(ATI)和相关辅助剂的麦麸蛋白饮食中(图1)。
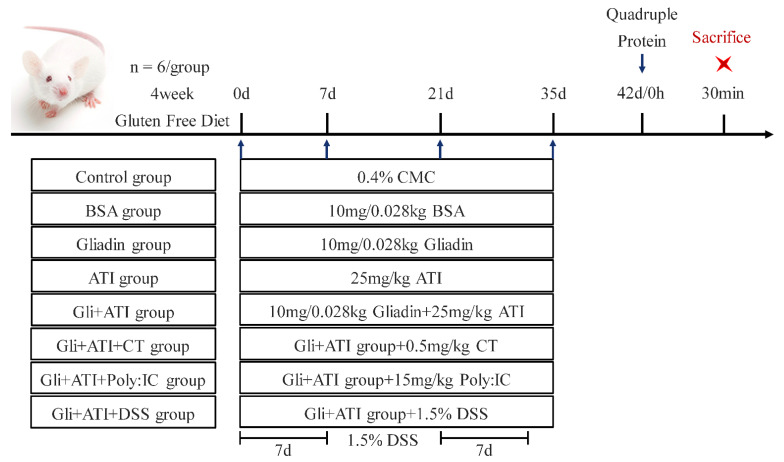
每次口服挑战时记录了小鼠的体重(图2A)。第一周组间动物的体重没有显著变化。之后,只有Gli+ATI+DSS组的小鼠显示出与其他组相比的体重下降趋势。样机组合测量了小鼠的日常饮水量,以排除DSS对其饮水的干扰,并发现水消耗没有显著差异(图2B)。此外,结果显示,Gliadin组和ATI组的小鼠表现出搔抓行为,而Gli+ATI组的两只小鼠出现腹泻症状(图2C)。Poly:IC或DSS的添加进一步加重了小鼠的症状。Gli+ATI+Ploy:IC组的小鼠症状最为严重,其中五只小鼠出现腹泻,一只小鼠出现呼吸急促。蛋白质挑战后小鼠直肠温度的变化如图2D所示。Gliadin组和ATI组的小鼠在刺激后体温下降到最低。相反,与麸质和ATI的共同刺激导致小鼠体温较对照组有所升高。
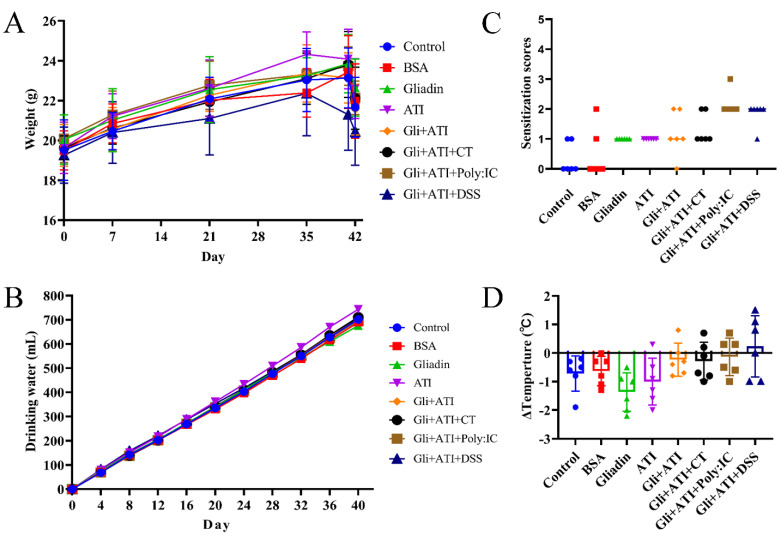
在图3中展示了肠道组织切片的病理特征和组织学变化,包括十二指肠、空肠、末端回肠和中段结肠。与对照组相比,Gliadin组和ATI组的小鼠在四个肠道部位表现出轻度萎缩和浸润。在小鼠的十二指肠、末端回肠和中段结肠切片中,Gli+ATI组、Gli+ATI+Poly:IC组和Gli+ATI+DSS组显示出明显的绒毛萎缩。此外,Gli+ATI组、Gli+ATI+CT组和Gli+ATI+Poly:IC组在小鼠空肠组织切片中表现出明显的腺体增生和浸润。综合而言,小鼠的肠道绒毛萎缩、腺体增生和浸润会在麸质和ATI的共同刺激下加重,其中Gli+ATI+Poly:IC组在四个肠道切片中显示出最严重的损伤。
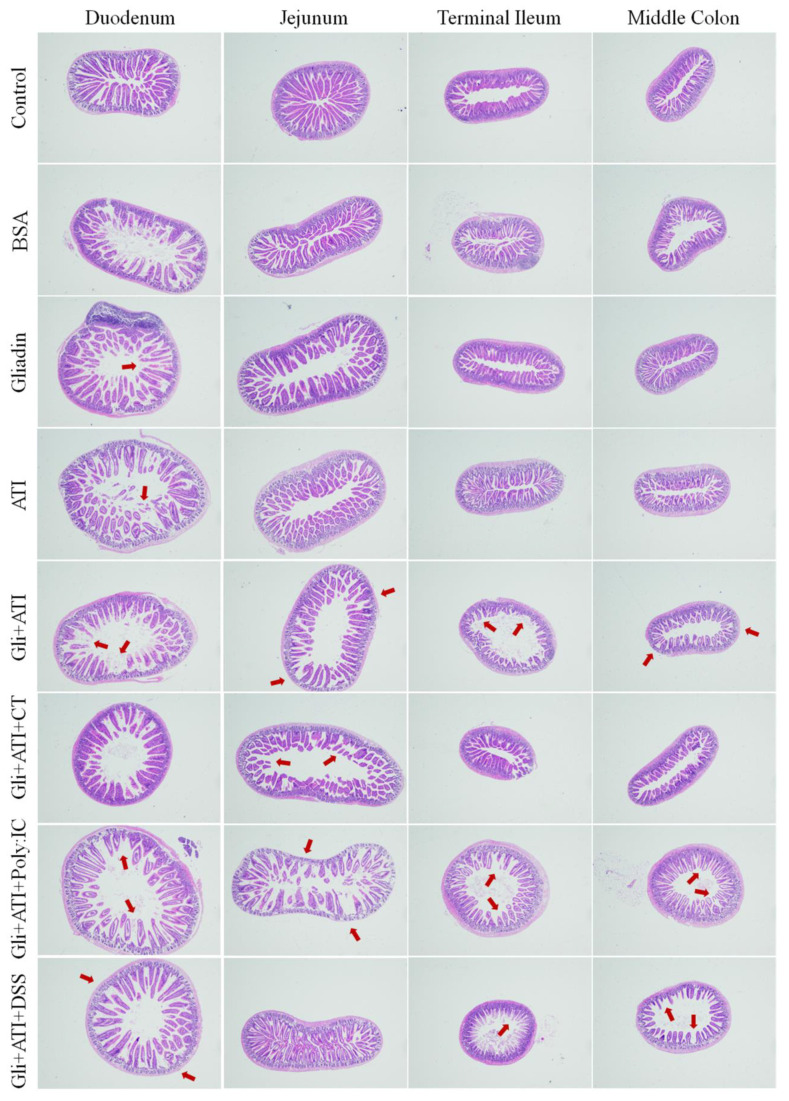
图4展示了空肠组织切片中组织转麦芽胺酶(tTG)和IL-15的免疫组织化学分析结果。如图4A、C所示,与对照组相比,醇溶蛋白(gliadin)显著增加了小鼠空肠组织中tTG的表达(p < 0.05)。与醇溶蛋白和ATI的共同刺激进一步促进了tTG的表达。此外,添加Poly:IC使小鼠空肠组织中的tTG表达达到最高水平。与tTG的结果类似,如图4B、D所示,醇溶蛋白还显著增加了小鼠空肠组织中IL-15的表达(p < 0.05)。总体而言,醇溶蛋白和ATI的共同刺激显著增加了小鼠空肠组织中tTG和IL-15的水平,而额外添加Poly:IC进一步加重了小鼠空肠组织中tTG的表达。
之后研究者对小鼠的脾脏进行了相关的检测。小鼠脾细胞中Th1/Th2的表达结果如图5所示。如图5A、C所示,与对照组(4.89%)相比,Gliadin组、ATI组、Gli+ATI+Poly:IC组和Gli+ATI+DSS组中Th1细胞的表达显著增加。Gli+ATI组、Gli+ATI+CT组与对照组之间没有显著差异。如图5B、D所示,与对照组相比,所有实验组中Th2的表达均显著降低。Gliadin组和Gli+ATI组的表达水平最低。此外,进一步比较了小鼠脾脏中Th1和Th2细胞的比例(图5E)。所有实验组均显示出较高的Th1/Th2比例。综合而言,醇溶蛋白和ATI的共同刺激能够严重破坏Th1和Th2细胞之间的平衡,使其朝向Th1免疫方向发展。
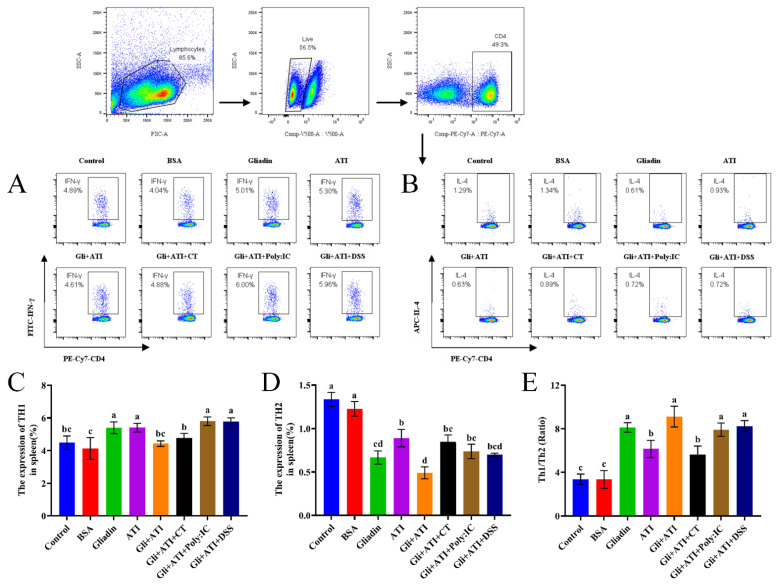
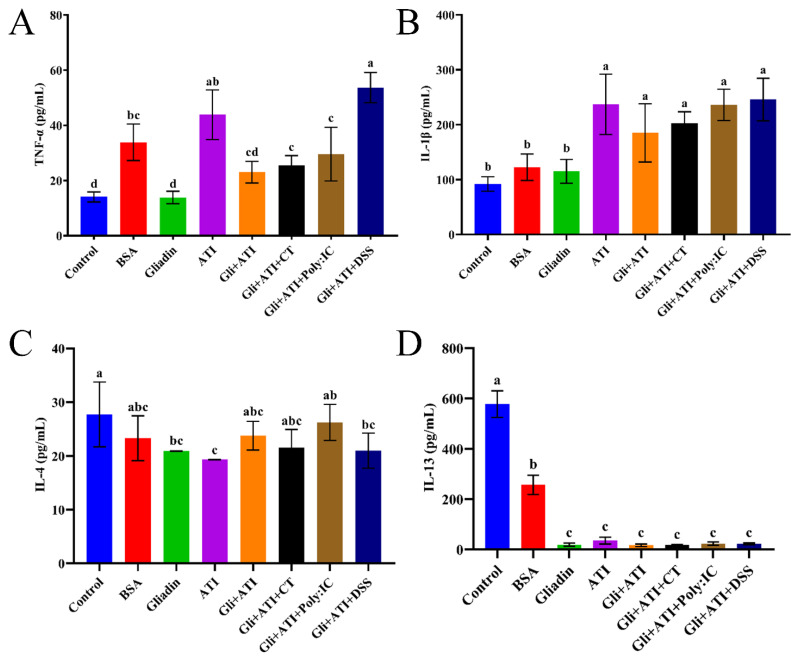
图6显示了小鼠脾细胞释放的细胞因子水平的变化。ATI的添加增加了Gliadin组小鼠脾细胞中TNF-α的水平。小鼠脾细胞中IL-4的水平与流式细胞术结果一致。此外,膳食中额外添加ATI的小鼠,其Th1细胞因子(IL-1β)的分泌显著增加,而Th2细胞因子(IL-13)显著抑制。这些显著差异仅在实验组与对照组之间的比较中得以体现。总体而言,再次验证了添加了醇溶蛋白和ATI的小鼠饮食能够破坏机体的Th1/Th2平衡,使其朝向Th1免疫方向发展。
Discussion
本研究使用BALB/c小鼠模拟了乳糜热的发展过程,重点研究了醇溶蛋白酶胰蛋白酶抑制剂(ATI)及相关辅助剂对免疫系统和肠道炎症的影响。结果显示,ATI可能加重与乳糜热相关的临床症状和体温,导致肠道损伤和免疫失调,特别是在Poly:IC的干预下。这一研究为深入理解乳糜热发病机制提供了新见解,为未来研究方向提供了参考。
本网站销售的所有产品及服务均不得用于人类或动物之临床诊断或治疗,仅可用于工业或者科研等非医疗目的。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


