近年来,随着大分子药物和细胞治疗药物的发展,细胞功能性实验在两者的开发过程中起着非常重要的作用,在其中,细胞杀伤功能的评价是一系列实验中重要的一环。我们知道在免疫系统中有多种具有杀伤功能的细胞,如自然杀伤细胞(NK)、细胞毒性T细胞(CTL)、具有ADCC作用的相关细胞等。细胞杀伤是在细胞免疫阶段,作用于靶细胞,使其裂解。
而如何检测,相信大家还有比较多的疑问,下面会向大家介绍常用的检测方式:
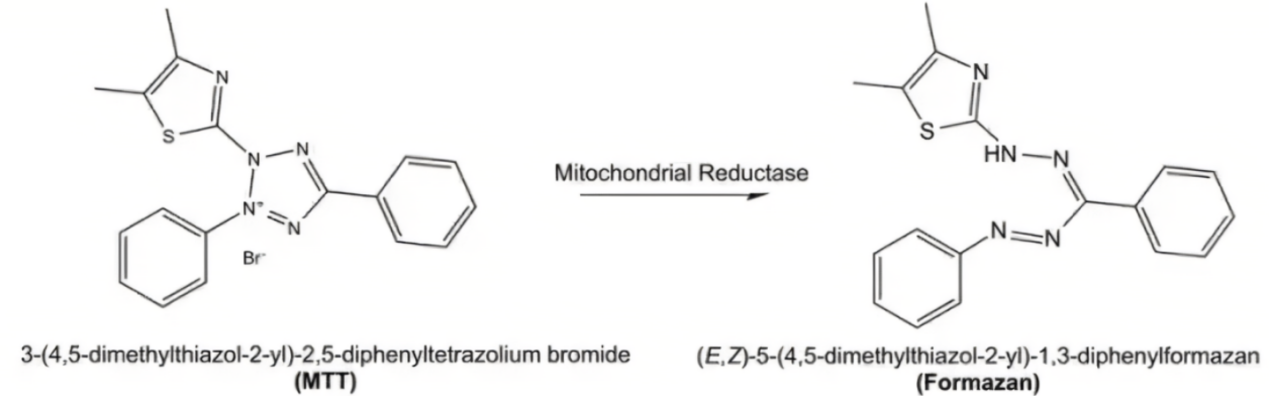
MTT还原法
检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性的MTT还原为水不溶性的蓝紫色结晶甲瓒,并沉积在细胞中,而死细胞无此功能。通过测定靶细胞代谢活性的减少来来反映效应细胞所致的靶细胞的死亡。
此方法的优点是简单易操作,无需标记靶细胞,可以高通量实验,同时还可以测量细胞增殖活性。缺点是此方法为间接法,与细胞状态关系比较大,容易出现假阴性;如果样本有微生物污染则可导致假阳性结果。
LDH释放法
乳酸脱氢酶(LDH)是活细胞胞浆内含酶之一,在正常情况下,不能透过细胞膜。当细胞受到损伤时,LDH可以透过细胞膜释放到培养基中。释放出来的LDH在催化乳酸生成丙酮酸的过程中,使氧化型辅酶I(NAD+)变成还原型辅酶I (NADH2),后者再通过递氢体-吩嗪二甲酯硫酸盐(PMS)还原碘硝基氯化氮唑蓝(INT)或硝基氯化四氮唑蓝(NBT)形成有色的甲簪类化合物,在490nm或570nm波长处有一高吸收峰,利用酶标仪读取的OD值,即可测得杀伤细胞的活性。
此方法属于间接法。虽然方法比较简单,可测的通量比较高,成本也相对比较低。但是也存在许多不足之处,例如,①如果存在效应细胞状态不好,会出现数据重复性不好,数据结果不稳定,这个细胞状态与个体差异及冻存复苏等均有比较大关系;②LDH可能存在部分自发释放现象,导致结果出现假阳性等。

报告基因转染法
利用基因转染技术将原核或真核生物的报告酶如β-半乳糖苷酶(β-galactosidase, β-gal)或荧光素酶(luciferase, luc)基因转染靶细胞,建立稳定转染靶细胞系, 以此测定细胞杀伤效应。通过测定释放入培养液中报告酶活性(代表靶细胞死亡数目), 便可计算出效应细胞杀伤靶细胞百分率。
本法优点在于:①灵敏度高, 自发释放背景低;②用不同报告基因转染的细胞系可同时测定杀伤效应, 结果互不干扰;③用不同的基因调控元件(如组织特异性的或活性可诱导的启动子)控制报告基因的表达,可进一步进行深入机制研究。其主要不足是建立报告基因稳定转染细胞系费时费力,这样会导致实验效率和周期变长,存在转染效率不高等因素影响,不利于生产。
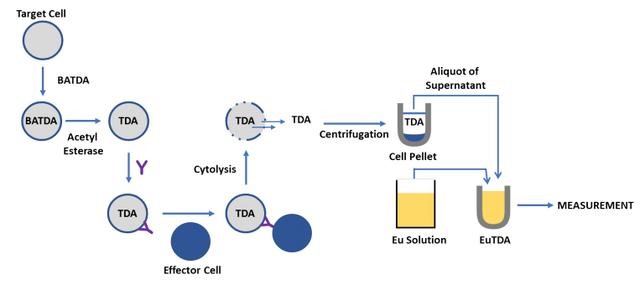
EUTDA细胞毒法
EuTDA细胞毒法利用荧光放大配体BATDA特异的标记靶细胞。BATDA能迅速进入细胞,并在水解作用下形成亲水的TDA留在细胞内,并在靶细胞裂解下释放,和相应试剂相结合形成强荧光、稳定的螯合物EuTDA用于检测。
相当于同位素释放方法的替代法,该方法灵敏度高,且更安全。相较于无法区分非特异死亡的LDH检测,EuTDA法不受效应细胞死亡和裂解的影响,降低背景的同时提升了检测的窗口和稳定性。相较于Calcein,BATDA能有效标记脆弱细胞,迅速被细胞摄取和在细胞裂解下完成高效的释放,为ADCC检测提供了稳定的检测窗口和易于标准化等优势。
流式细胞法
流式细胞法包括PE-mAb/FITC-Annexin V荧光标记法、DIOC18/PI荧光标记法、PKH-26/CFSE荧光标记法等。
PE-mAb/FITC-Annexin V荧光标记法原理是利用流式细胞仪将PE结合的效应细胞特异的单克隆抗体标记的效应细胞、非标记的靶细胞及FITC-AnnexinV标记的早期凋亡细胞分群,即可计算出效应细胞杀靶细胞的百分比,本方法简单快速、无需预标记。
DIOC18/PI荧光标记法原理是DIOC18标记细胞膜,PI标记效应细胞核死亡靶细胞,通过流式分析区分两类细胞,优点是不需要活化靶细胞。
PKH-26/CFSE荧光标记法原理是利用双标法有效标记和区分靶细胞,优点是自发荧光低。
以上方法,需要找到合适的细胞类型和实验目的,不适用与广谱细胞杀伤实验检测,实验者也同时需要评估细胞生存力、荧光强度、荧光峰值的变异系数、染色均一性等;同时流式细胞仪操作也需要专业的操作人员,相对比较繁琐。

LabEx 作为多因子实验服务专家,可提供Luminex/MSD/CBA等多因子检测服务,还提供流式细胞分析、细胞增殖\凋亡、细胞功能等细胞实验服务、此外在在工业上,LabEx 提供体外细胞功能实验、体内模型的免疫药效等方面的检测服务,速度快,质量高,服务更专业。此外,LabEx还可以提供以下服务平台:







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


