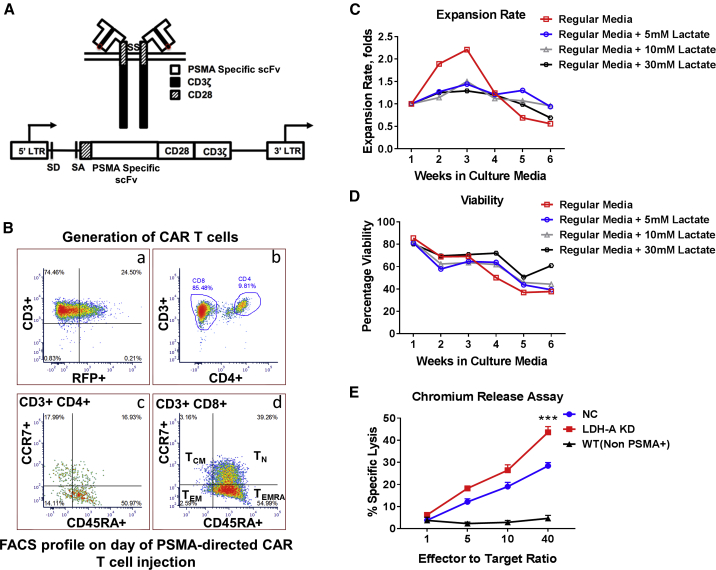
对肿瘤抗原具有高度特异性的TCR基因工程,称为T细胞嵌合抗原受体(CAR T细胞)。在该技术中,从携带肿瘤的患者中获得 T 细胞,并通过慢病毒或逆转录病毒插入所需的基因,然后将其输入患者体内。由于这些细胞是自体的,因此不存在 GVHD(移植物抗宿主病)的风险。FDA批准的两种 CAR T 细胞疗法均靶向 CD19 。
血液系统恶性肿瘤中不存在所谓的“非物理”肿瘤微环境 (TME) 经常被提及。实体瘤中的 TME 更为复杂,具有物理屏障、多种免疫抑制机制以及多种癌代谢物限制了 CAR T 细胞治疗的疗效。其一为乳酸,与有氧糖酵解有关,TME 中高乳酸水平的存在通常与酸性细胞外 pH 值 (6.5) 以及体外和体内CD8 + T 细胞和自然杀伤 (NK) 细胞的数量和活性较低有关。已显示高乳酸可抑制 T 细胞功能,包括白介素 (IL)-2 分泌和 T 细胞受体的激活。阻断肿瘤细胞中的乳酸脱氢酶 A (LDH-A) 可改善免疫功能和抗程序性细胞死亡 1 (PD-1) 疗法的功效。
研究发现降低肿瘤细胞中的 LDH-A 消除了 T 细胞进入实体瘤的空间限制。
为了增强 T 细胞的靶向性和穿透性。作者研究并成像了 LDH-A 消耗(LDH-A 短发夹 RNA [shRNA] 敲低 [KD])对肿瘤代谢和 TME 特定成分对肿瘤生长的影响。以期揭示 第二代 hPSMA CAR 导向 T 细胞疗法的疗效。

结果
影响肿瘤细胞的生长
使用两种不同的方法来实现 LDH-A KD:一种基于由 Tet 调节 (TRE) 启动子调节的 shRNA,另一种是对 LDH-A 特异的组成型表达的 shRNA。
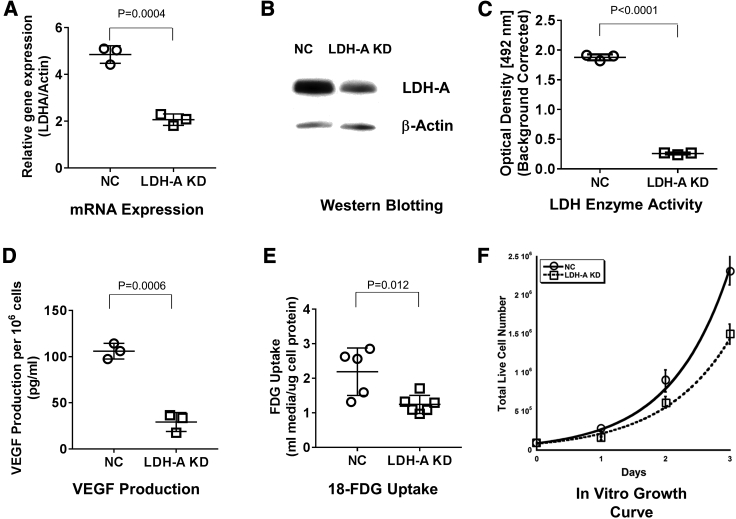
1、KD 细胞中 LDH-A mRNA 表达、LDH-A 蛋白表达、LDH 酶活性、血管内皮生长因子(VEGF)产生和18 F-氟脱氧葡萄糖(18 F-FDG)摄取显著低于 NC 细胞;
2、体外生长曲线显示 LDH-A KD 细胞的生长比 NC 细胞慢;
3、KD 细胞的氧化磷酸化率高于 NC 细胞;
4、LDH-A KD 细胞比 NC 细胞消耗更少的葡萄糖、产生更少的乳酸。
结果提示:两种系统都显著下调 LDH-A 表达。
影响前列腺瘤的生长
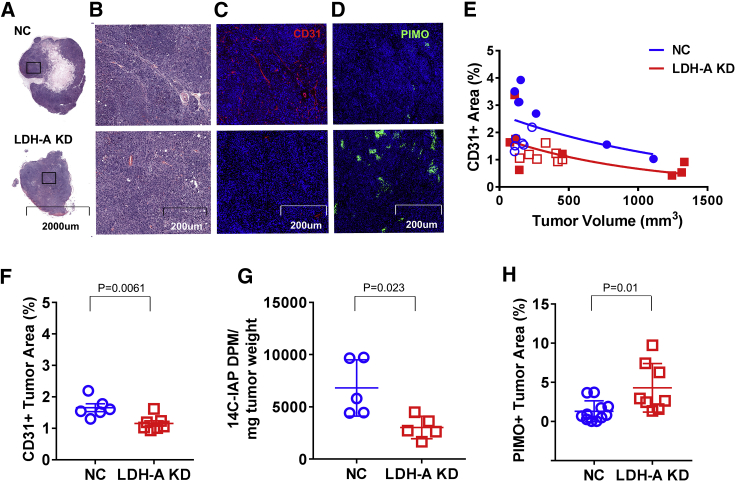
确定不同成分占总肿瘤面积的百分比,包括活的肿瘤细胞、基质、出血和坏死+基质胶。
1、NC 肿瘤在肿瘤植入后 12-14 天显示出比 KD 肿瘤更大的 MVD;
2、CD31 +染色密度是肿瘤体积依赖性的并且随着肿瘤体积的增加而降低;
3、KD 中的 CD31 +血管染色低于 NC 肿瘤;
4、血管通透性显示 KD 和 NC 肿瘤之间的摄取没有差异。
体外乳酸研究
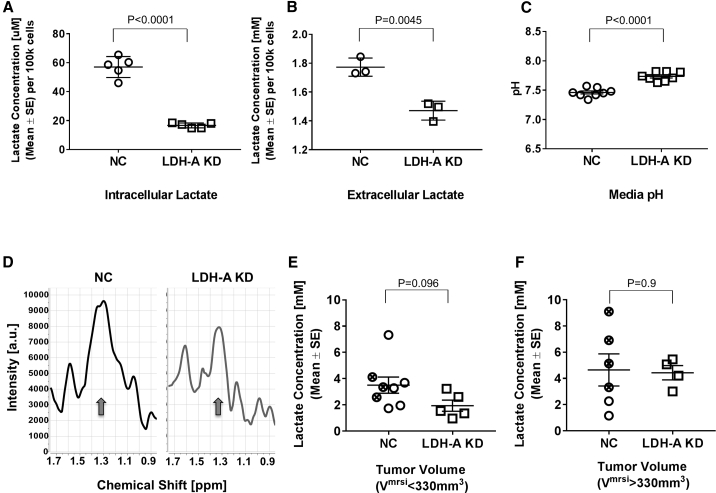
1、在标准培养基中孵育 72 小时后,LDH-A KD 中细胞内和细胞外(培养基)的乳酸浓度低于 NC 细胞。;
2、与 KD 细胞相比,NC 的培养基 pH 较低;
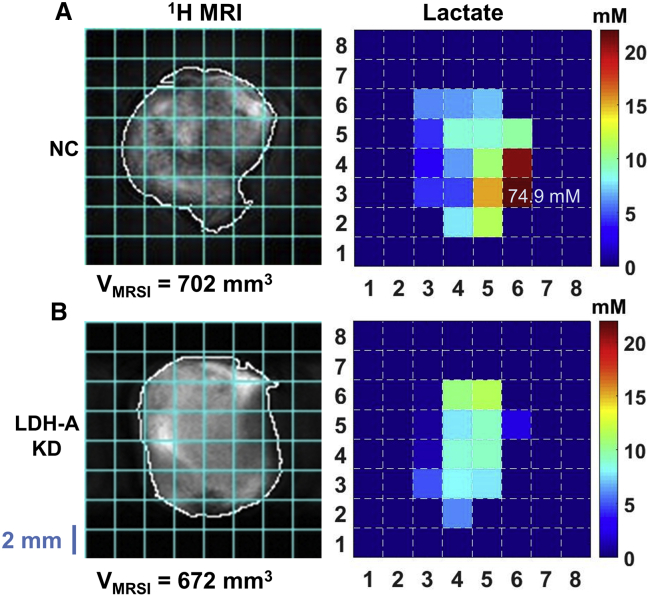
3、与小型 KD 肿瘤相比,大型 KD 肿瘤的乳酸水平显著升高。
靶向药物研究
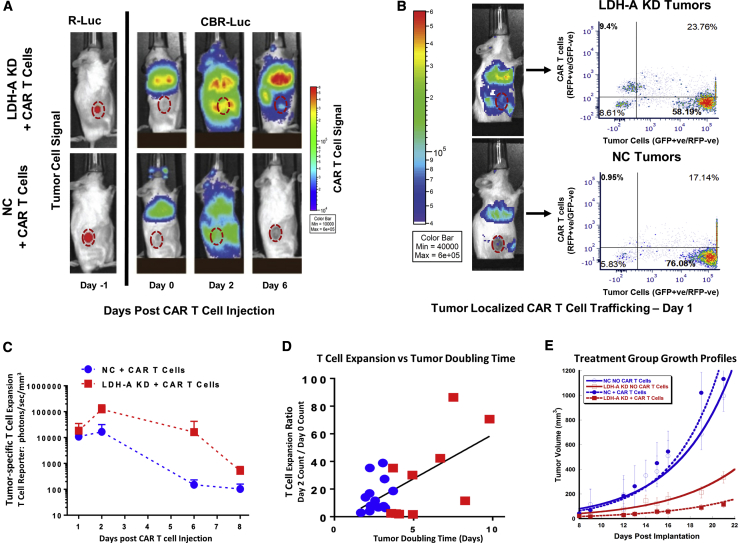
试图确定肿瘤 LDH-A 的消耗和肿瘤乳酸的变化是否会导致 TME 的变化,从而使这些肿瘤更容易接受 CAR T 细胞的递送。用 Plg28z 抗 hPSMA CAR 和串联二聚体红色荧光蛋白 (tdRFP)/ (CB)RLuc 双光学报告基因转导原代人 T 细胞。
1、治疗当天 CAR T 细胞的流式细胞仪分析显示 CAR T 细胞的效应记忆(CCR7 -,CD45RA +)群体占优势。CAR T 细胞的体外扩增在第三周达到顶峰;
2、暴露于高水平乳酸的 CAR T 细胞表现出增殖和扩增减少;
3、与 NC 肿瘤细胞相比,CAR T 细胞对 LDH-A KD 肿瘤细胞的细胞毒性更高;
4、87% 的 T 细胞有抗 hPSMA CAR 表达,67% 的 CAR +T 细胞对 tdRFP/CBRLuc 融合报告基因 (RFP) 呈阳性。
5、在 CAR T 细胞注射后的第 1、2、6 和 8 天,KD 中的平均 BLI 强度比 NC 肿瘤高 2、7、108 和 5 倍;
结果提示: LDH-A KD 是减少肿瘤生长的主要因素。在存在和不存在 CAR T 细胞治疗的情况下,KD 和 NC 肿瘤之间的肿瘤倍增时间差异显著。
影响细胞和肿瘤中 hPSMA 表达的调节
使用MyC-CaP:hPSMA + RLuc-IRES-GFP开发了稳定转染的克隆 (LDH-AK),以及带有如前所述的乱序 shRNA 的对照 (A5NC) 细胞系。
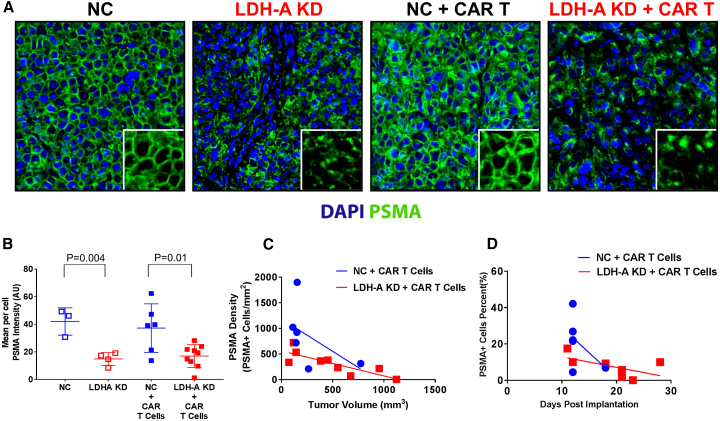
1、每个细胞的 hPSMA 染色强度在NC 中显著高于 LDH-A KD 肿瘤细胞,hPSMA +细胞的密度也是如此;
2、随着时间推移在 MyC-CaP hPSMA +肿瘤细胞中观察到的细胞表面 hPSMA 表达丧失。
结论
与对照细胞和肿瘤相比,LDH-A 下调显著抑制细胞增殖和皮下肿瘤生长。然而,LDH-A 敲低和对照肿瘤之间的总肿瘤乳酸浓度没有显著差异,这反映了 LDH-A 敲低肿瘤中较低的血管分布、血流和乳酸清除。比较 MyC-CaP 肿瘤与 LDH-A 耗竭和/或抗 hPSMA CAR T 细胞的治疗反应表明,对肿瘤生长的主要影响是 LDH-A 耗竭。使用抗 hPSMA CAR T 细胞治疗时,与肿瘤 LDH-A 消耗相结合,与对照肿瘤生长相比,肿瘤生长显著减缓(p < 0.0001)。
讨论
大多数肿瘤都具有需氧糖酵解代谢成分,并且糖酵解产生的乳酸在局部环境中具有免疫抑制作用,如慢性炎症、败血症和自身免疫性疾病等。乳酸抑制细胞毒性 T 细胞增殖和细胞因子产生,导致免疫反应显著降低。通过 LDH-A 的基因缺失降低乳酸水平已被证明可以通过降低 MDSC 的数量和改善 NK 细胞功能来增强免疫反应。
CAR T 细胞动力学的体外监测表明,在乳酸存在的情况下,T 细胞增殖减少和 MyC-CaP:hPSMA +肿瘤细胞细胞毒性降低。
CAR T 细胞的寿命相对较短。这可以用几个因素来解释:
(1) 研究中 CAR T 细胞主要由效应记忆 CD8 +群体组成,已知它是离体扩增的 CAR T 细胞的短寿命子集;
(2) 当被抗原阳性肿瘤刺激时,快速分裂的效应记忆 T 细胞经历活化诱导的细胞凋亡;
(3) 随着时间的推移,在体外和体内降低 hPSMA 抗原的细胞表面表达,对 LDH-A KD 的影响比在 NC 细胞和肿瘤中的影响大。
研究结果提示肿瘤代谢和 TME“正常化”的重要性。这些成分(肿瘤代谢、微环境、靶向抗原表达和 CAR T 细胞功能)之间的相互作用有助于癌细胞如何逃避免疫破坏。更好地理解这种关系可能会建立更有效的 CAR T 细胞治疗策略。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


