|
免疫组化是个苦活,时间长,步骤多,还要经常接触有毒致癌物质。大家辛辛苦苦如何才能染出了漂亮的片子,并分析出得出自己想要的结果呢? 免疫组化,免疫组织化学技术(immunohistochemistry),是一项利用抗原抗体反应,通过使标记抗体的显色剂显色来确定组织细胞内抗原,对蛋白定位,定性的实验技术。 免疫组化主要用的是组织标本和细胞标本两大类,组织标本包括石蜡切片(病理切片和组织芯片)和冰冻切片。 石蜡切片,对组织形态保存好,保存时间也长,虽然对组织抗原暴露有影响,但可以抗原修复,所以石蜡切片仍然是首选的标本制作方法。
1、在60°烤箱烤片30~60min,这一步是为了使蜡片水分蒸发和石蜡融化,好让组织切片牢固贴在玻片上。做切片是免疫组化的前提切片子最好是找专业培训郭的人员切片,片子的厚薄均匀,切片的完整,无褶无刀痕。 2、脱蜡水化,依次放入二甲苯I、II、III各10min,乙醇梯度(高至低)各2min,水。然后用自来水洗一下,但不要直接对着切片冲洗。 3、抗原修复,小编用的是高压热修复,ph6.0的柠檬酸盐缓冲液,一定要全部浸泡切片,等高压锅冒气后5min结束,自然冷却,温度剧降可能引起脱片哦。3%H202避光浸泡15min。 4、用免疫组化油笔围绕组织画圈,接下来就能看见它的功效了。PBS洗5min*3次。PBS会被锁在画的圈中,不会流干,保证不干片。
很多时候,我们千辛万苦地染出了一张张漂亮的免疫组化片子。如何正确地分析,得出理想的结果。 结果分析主要有两种方法,阳性着色细胞计数法和评分法。 前者是在40*光镜下,随机10个视野下计数阳性着色细胞; 后者则是在光学显微镜下按染色程度(0分阴性着色,1分淡黄色,2分浅褐色,3分深褐色)和阳性范围(1分0-25%,2分26-50%,3分51-75%,4分76-100%)评分,最终分数相加。
没有对照染色的免疫组化结果是不可信的。对照一般有阳性组织对照,阴性组织对照,阴性试剂对照,自身对照。一般来说,有一个阳性组织对照和一个阴性组织对照就足够了。
抗原表达必须在特定部位。如LCA应定位在细胞膜上;CK应定位在细胞浆内;PCNA及p53蛋白应定位在细胞核内等等。不在抗原所在部位的阳性着色,不能视为确切的阳性结果。有可能是非特异性染色或者假阳性。不能确定怎么办?这就要用到上一段提到的对照染色了。
因为人为主观性比较强,所以只能称作半定量。免疫组化的半定量一般就分为三级:弱(+),中(++),强(+++)。以绿色免疫荧光为例,则表现为浅绿色荧光、明显绿色荧光和亮绿色耀眼荧光。弱(+)=1,中(++)=2,强(+++)=3。至少随机观察5-10个视野。然后根据(+)% x 1 +(++)% x 2 +(+++)% x 3计算出数值;总数值<1.0者为(+),1.0-1.5者为(++), >1.5者为(+++)。
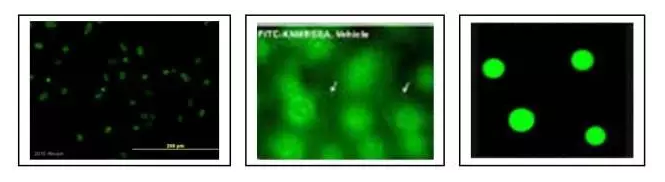
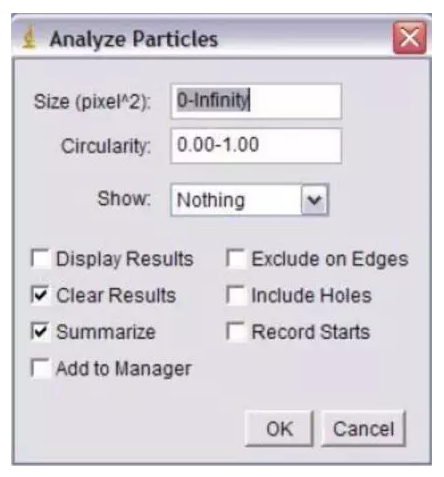
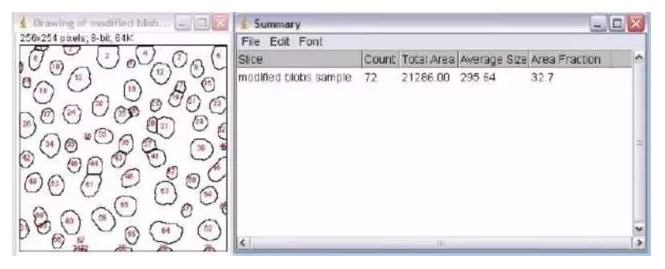
如果要进行精确定量的话,就要用到图像分析软件。图像分析软件类型很多。 一款图像分析软件: Image J。NIH开发的免费软件。一般的免疫组化结果分析用它就绰绰有余了。现在已经开发到了1.50版。网上可以免费下载。其界面非常简洁,如下图所示: 现在,根据一个实例来看看如何用Image J来进行图像分析。如下图所示,我们有一张细胞的免疫荧光染色的照片。那么,如何用Image J来计数细胞的个数呢? 首先,要把彩色的图像转换成黑白图像。 步骤如下:Image→Type→16-bit。转换成黑白图像后,将要计数的部分用高亮标示出来。 步骤如下:Image→Adjust→Threshold。然后拖动鼠标,直到所有的细胞被标示出来。 有时候2个细胞靠得比较紧密,会被计数为1个细胞。这个时候可以采用Image J的水洗功能。 步骤如下:Image→Binary→Watershed。如下图的蓝色箭头所示,这些是本来计数成一个的细胞,经过水洗之后,更加精确地被计数成2个细胞。 然后,就可以正式开始分析了。 步骤如下:Analyze→Analyze Particles。在得出最后的结果之前,还有一些选项需要选择。 如果想要计数全部的细胞,那么Size项里面选择“0-infinity”。Circularity的默认值为“0.00-1.00”。一般就取默认值。 最后的结果如下图所示。软件自动测量了每个细胞的大小。这里因为是二维图像,所以就是每个细胞的面积。然后计数了一共有72个细胞,总面积为21286.00,平均大小为295.64。 labex提供技术: 多重免疫组化 |










 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


