|
这周的文献选自《Cell》名为“Stress-Induced Metabolic Disorder in Peripheral CD4+T Cells Leads to Anxiety-like Behavior”通过在小鼠中模拟应激的环境,进一步分析T细胞的变化,以及线粒体相关代谢途径发挥的作用。
身体或精神上的压力会导致大脑的神经可塑性,增加抑郁和焦虑的风险。压力暴露导致外周血T淋巴细胞功能障碍。然而,外周T淋巴细胞在情绪障碍中的病理作用和潜在的调节机制尚未得到充分的认识。在这里,作者发现CD4+T细胞的缺乏可以保护小鼠免受压力诱发的类似焦虑的行为。物理应激诱导的白三烯B4触发CD4+T细胞严重的线粒体分裂,进一步导致各种行为异常,包括焦虑、抑郁和社会障碍。代谢组学和单细胞转录组研究显示,CD4+T细胞来源的黄嘌呤通过腺苷受体A1作用于左侧杏仁核的少突胶质细胞。线粒体分裂通过CD4+T细胞中干扰素调节因子1的积累促进嘌呤的新生合成。作者的研究表明,CD4+T细胞中的嘌呤代谢紊乱与压力驱动的类似焦虑行为之间存在关键联系。
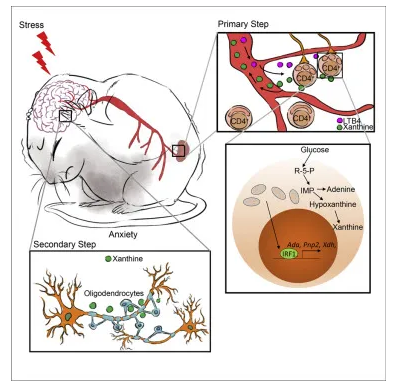
CD4 + T细胞是应激诱导的焦虑行为的重要组成部分
为了检查适应性免疫系统在应激诱导的行为变化中的作用,作者连续8天将野生型(WT)或重组激活基因1(Rag1)-/-小鼠暴露于电子足部电击(ES),以诱导焦虑模型(图1A)。与野生型小鼠相比,免疫缺陷的Rag1-/-小鼠在开放场试验(OFT)中对探索中心区域和运动的兴趣并未降低(图1B),说明适应性免疫是焦虑发作所必需的。与未经治疗的(NT)对照相比,具有急性ES暴露的小鼠的外周CD4+和CD8+淋巴细胞的频率和数量显着增加(图S1A和S1B)。
为了研究哪些淋巴细胞亚群参与ES诱发的情绪障碍,作者在诱导ES模型之前通过静脉内(iv)注射消除了CD4+或CD8+T细胞(图1A),并通过FACS验证去除的效率。结果显示只有CD4+T细胞的耗竭才能显着逆转ES诱导的OFT和高迷宫(EPM)测试中的焦虑样行为(图1C-D)。为了进一步确认CD4+T细胞在CS中的作用,作者将ES模型的程序延长至30天。如图S1D所示,慢性ES诱导的焦虑样行为也需要CD4+T细胞。与ES模型相反,急性束缚应激(RS)模型降低了CD4+T细胞的频率(图S1E),这与焦虑症患者的观察结果一致(图S1F)。然而,CD4+T细胞的缺乏仍然阻止RS治疗的小鼠发展为焦虑(图1E),这表明CD4+ T细胞对物理应激诱导的焦虑样行为具有广泛的影响。
为了评估T细胞是否保留焦虑印迹,NT或ES诱导的脾脏CD4+或CD8+T细胞被过继转移到Rag1-/-小鼠(图1F)。只有ES诱导的CD4+T细胞的Rag1-/-小鼠在OFT中出现了类似焦虑的行为(图1G)。令人惊讶的是,NT CD4+T细胞诱导了弱焦虑样症状,这表明一些来自CD4+T细胞的天然产物具有调节物理反应的能力(图1G)。T细胞衍生的IFN-γ也被证明参与调节神经元连接和社会行为。在没有额外刺激的情况下,ES小鼠脾脏CD4+T细胞的IFN-γ表达显著低于NT小鼠(图S1G)。然而,血清IFN-γ与NT小鼠相比无差异,原因是总细胞数增加(图S1H)。
为了阐明焦虑中的病理CD4+ T细胞是否依赖于它们的激活来发挥其功能,作者比较了naive和效应 CD4+ T细胞通过过继转移到Rag1-/-小鼠中诱导焦虑症状的能力。除了单纯的CD4+T细胞外,作者还加入了两个效应组,包括效应 l组(来自同一只小鼠)和效应H组(相同的细胞数量)。虽然转移的naive和效应CD4+T细胞表现出类似的激活特征(图S1I),但是naive CD4+T细胞引发的焦虑比两个效应型对照组更严重(图1H)。因此,这些数据说明CD4+T细胞在压力诱发的焦虑中扮演着重要的角色,而不依赖于它们的激活状态。
 图1 图1


补充图1
应激诱导周围CD4+T细胞线粒体裂变
为了检验CD4+和CD8+T细胞影响焦虑的不同能力,研究人员通过RNA测序(RNA-seq)分析了naïve ES诱导的CD4+和CD8+T细胞的转录组。虽然ES CD4+T细胞中的大部分基因与其他三组相似(图2A和表S1),但ES诱导的CD4+T细胞中鉴定出128个特异性差异表达基因(DEGs)(图2B和2C)。基因本体论(GO)分析显示,这些DEGs中有大量编码线粒体蛋白(图2D)。此外,通过细胞外酸化率(ECAR)和氧消耗率(OCR)分别检测,ES和rs处理后的初代CD4+ T细胞糖酵解水平和氧化磷酸化水平(OXPHOS)均严重降低(图2E-F)。这些数据表明,应激影响线粒体的结构,从而深刻影响线粒体的生物发生和功能。共聚焦显微镜图像显示,ES处理过的幼稚CD4+T细胞主要表现为点状线粒体(图2G)。免疫印迹(IB)进一步显示,ES处理后的naive CD4+T细胞中,介导线粒体融合的外膜蛋白,包括MFN2和MIGA2显著减少(图2H)。综上所述,这些数据表明CD4+T细胞在应激下表现出异常的线粒体形态和代谢功能障碍。
各种神经递质和激素,包括多巴胺、皮质醇、GABA、肾上腺素、l -谷氨酸和血清素已被证明与焦虑的发作有关。一些研究结果表明,抑郁的动物大脑中omega-6脂肪酸和花生四烯酸(AA)的含量增加。在所有AA代谢产物中,应激诱导的LTB4触发外周血CD4+T细胞线粒体分裂和焦虑的发生(图2I-L),但其潜在机制仍有待进一步研究。

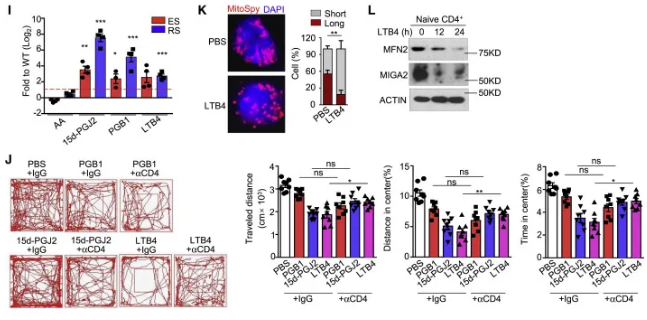
图2
具有多种线粒体形态的CD4+T细胞引起严重的焦虑症症状
为了进一步证明T细胞的线粒体形态与焦虑行为间的关系,作者生成了Mitoguardin 2 KO(Miga2-/-)小鼠,并在幼稚的CD4+T细胞中观察到了高度破碎的线粒体(图3A)。用电子显微镜(EM)进行的超微结构分析进一步证实了许多小的,多样化的线粒体分散在Miga2-/-幼稚的CD4+ T细胞的细胞质中(图3B)。有趣的是,Miga2缺陷型小鼠的自发活动减少,并且在中心区域花费的时间比其在OFT中的野生同窝小鼠的时间少得多(图3C)。这些miga2缺陷小鼠在EPM试验中明显害怕进入开放臂(图3D)。
与ES应激模型中的数据相似,CD4+耗竭,而不是CD8+耗竭,T细胞恢复了由连续线粒体分裂引起的焦虑症状(图3E)尽管炎性小胶质细胞通过抑制多巴胺的释放而导致抑郁和焦虑,小胶质细胞不参与由Miga2缺乏引起的焦虑发作。与Miga2缺陷的原始CD4+T细胞过继转移的受体Rag1-/-小鼠进一步证实了这些细胞在焦虑中的重要作用(图3F)。整联蛋白VLA-4和CD6均在T细胞表面表达,并允许这些细胞穿透血脑屏障(BBB)。为了阐明这些“焦虑的” CD4+T细胞是否在CNS中起作用,作者用VLA-4或CD6中和抗体处理了Miga2-/-小鼠,破坏了T细胞向CNS的迁移。VLA-4和CD6抗体均未对Miga2缺陷型小鼠的焦虑症状产生任何影响。所有这些数据表明,Miag2缺乏症引起的焦虑与病理性CD4+T细胞迁移到大脑无关。
Miga2 TKO小鼠仍然表现出类似于Miga2 -/-小鼠的焦虑样行为(图3G)。此外,Miga2 TKO在连续的EPM测试中,小鼠表现出恐惧记忆正常消退(图3H),表明Miga2缺陷型CD4+T细胞对正常的学习和记忆没有影响。为了消除MIGA2蛋白在焦虑中的特定功能,作者生成了Mfn1和Mfn2 T细胞条件性双KO(Mfn1/2 T KO)小鼠。行为评估表明,与野生型同窝小鼠相比,T细胞中缺乏Mfn1/2的小鼠也表现出焦虑样行为(图3I),表明焦虑行为是由线粒体的形态障碍促进的,而不是由CD4+T细胞中某些线粒体蛋白的特定功能促进的。
图3
之后作者进一步对T细胞的线粒体中嘌呤代谢进行了进一步分析,发现病理性CD4+T细胞引起的过量黄嘌呤在焦虑的发生中起着关键作用。且之后通过对杏仁核中小胶质细胞和少突胶质细胞的研究发现黄嘌呤直接触发少突胶质细胞的增殖,Miga2-/- T细胞引起的过量黄嘌呤通过左侧杏仁核的A1受体作用于少突胶质细胞,促进焦虑样行为。
IRF-1是一种转录因子,参与多种细胞过程,包括细胞增殖、分化、凋亡和免疫调节。作者之前的研究表明,组成性线粒体分裂促进先天免疫细胞中IRF-1的积累,作者经过一系列实验发现,CD4+T细胞中的IRF-1在线粒体分裂介导的嘌呤合成和焦虑症状中起着重要作用。
总结:
1. 外周CD4+T细胞控制应激诱导的焦虑样行为
2. 周围CD4+T细胞的线粒体裂变引起严重的焦虑症状
3. T细胞来源的黄嘌呤作用于左侧杏仁核的少突胶质细胞
4. IRF-1控制CD4+T细胞中嘌呤的合成并引发焦虑症
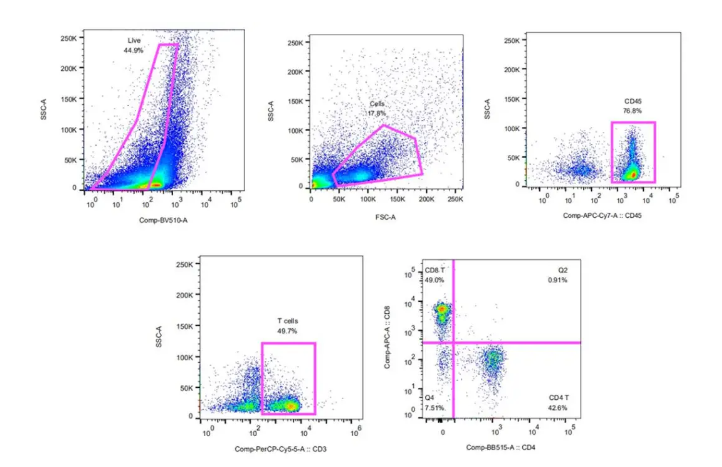
本文涉及技术: 流式细胞术
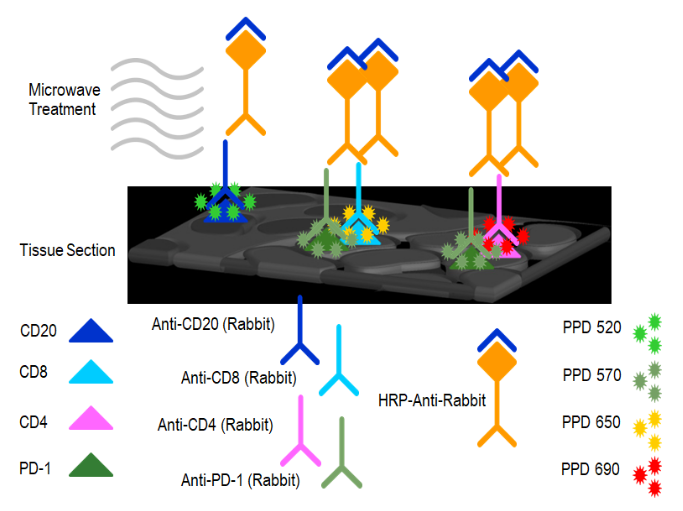
本文涉及技术: 多重免疫组化
本文涉及技术: 单/多因子检测
|

















 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


