根据最新的数据和报告,中国目前已经进入“深度老龄化”阶段。截至2023年,中国65岁及以上的老年人口比例已经达到15.4%,这一比例在全球范围内属于中上水平。预计到2030年左右,中国65岁及以上老年人口比例将超过20%,进入“超级老龄化社会”。到2050年,高龄老人(80岁及以上)在总人口中的占比预计将超过10%。
随着人类寿命的增加,神经退行性疾病的患病率也逐年上升。世界卫生组织预测,到2040年,神经退行性疾病将成为人类第二大致死疾病。其中阿尔茨海默病(Alzheimer's disease,AD)是最常见的神经退行性疾病,占所有痴呆病例的60-70%,其次为帕金森病(Parkinson's Disease,PD),全球患病人数超过600万。因此探索神经退行性疾病的生物标记物,改善临床检查和诊断是非常必要的。

Pubmed神经退行性疾病相关研究文章数量
阿尔茨海默症
阿尔茨海默症(AD)是一种常见的神经退行性疾病,临床上以记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍以及人格和行为改变等全面性痴呆为表现特征。
经典指标:Aβ、Tau
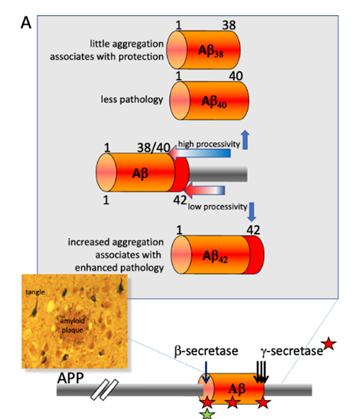
β-淀粉样蛋白(Amyloid-beta,Aβ),是β-淀粉样前体蛋白(APP)被β-, γ-分泌酶切割成的含有38-43个氨基酸不等的多肽片段,例如Aβ38、40、42
Aβ的聚集会堵塞离子通道,从而使钙离子稳态失衡并出现各种代谢异常,最终导致神经元的死亡。
除此之外,Aβ斑块还可以激活小胶质细胞,引发神经炎症。这些炎症反应释放的细胞因子和化学因子可能会进一步损害神经元和突触功能。

Tau蛋白是一种在神经轴突中表达的微管结合蛋白,对调节神经元中微管的稳定性具有重要作用。当体内GSK-3β和CDK5等激酶对Tau蛋白过度磷酸化后,Tau蛋白将从微管上分离,从而使微管失去稳定性并导致神经元凋亡,从而引起疾病的发生。
帕金森病
帕金森病(PD)是中老年人群中常见的神经系统变性疾病,临床特征以静止性震颤、运动障碍或迟缓、姿势不稳、僵硬、平衡失调为主。
经典指标:α-Synuclein
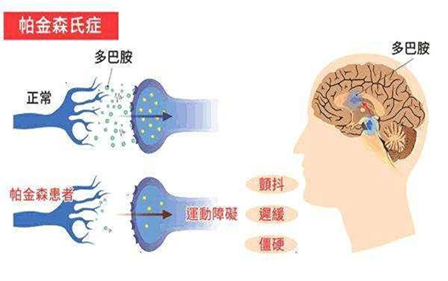
当基因突变或环境因素引发α-Synuclein发生错误折叠时,会导致α-Synuclein的聚集,形成路易小体(Lewy Body),它们会改变多巴胺信号转导,最终导致神经元功能紊乱和细胞死亡。
主要病理变化是脑部黑质致密部中多巴胺能神经元的退行,这些神经元参与将多巴胺传递到另一个基底神经节的过程,它们的退行会导致包括运动皮层区在内的神经元回路的功能障碍。
神经退行性疾病的解决方案
(1)因子检测手段
神经退行性疾病,传统通过影像学技术拍片观测脑部淀粉样堆积情况评估疾病进程,但模型动物或病人脑部出现淀粉样堆积往往在疾病发生中晚期。通过检测Biomarker,可以更早的预测疾病发生,更好的评估药物疗效和毒副作用。
常使用的神经退行性疾病Biomarkers涉及: APP、Aβ38、Aβ40、Aβ42、Cystatin C、DJ-1/PARK7 、KC/GRO、MCP-1、TNF-α、Tau、VEGF-A、a-Synuclein、IL-2、Enolase 2、LRRK2 LRRK2(pS935) 、VILIP-1等。
除此之外,在最近的神经炎症与神经退行性疾病最新进展,也特别提到炎症在神经退行性疾病研究中的重要性。

研究目的:验证血浆p-tau217与正电子发射断层扫描(PET)在4RT相关综合征中,尤其是皮质基底综合征(CBS)的准确性。
研究方法:血浆中的p-tau217水平通过MSD(Meso Scale Discovery)平台进行检测量。并与淀粉样蛋白β(Aβ)和flortaucipir(FTP)PET进行验证。实验操作者对样本队列进行盲测,以确保结果的客观性。

研究结果:在386名参与者中,199名(52%)为女性,平均(标准差)年龄为68(8)岁。CBS患者中,Aβ PET或FTP PET阳性者的血浆p-tau217水平升高,与AD对照个体相当,而PSP-RS和nfvPPA患者与对照组相比没有增加。在CBS中,p-tau217在Aβ PET的ROC曲线下面积(AUC)为0.87(95% CI, 0.76-0.98; P < .001),FTP PET的AUC为0.93(95% CI, 0.83-1.00; P < .001)

结论和相关性:这项队列研究表明,血浆p-tau217在识别CBS中可能的AD病理的Aβ或FTP PET阳性方面具有出色的诊断性能。血浆p-tau217可能是一个有用且成本低廉的生物标志物,用于CBS临床试验中的患者选择。
(2)单细胞测序检测手段
单细胞测序(single-cell sequencing)技术为神经退行性疾病的研究提供了一个强大的工具,在神经退行性疾病研究中的应用正变得越来越重要。因为它不仅能够揭示细胞异质性和细胞类型特异性的分子变化,还有助于深入理解疾病的复杂性,并为诊断、治疗和预防提供了新的方向。

研究目的:在AD病理背景下,确定Abi3基因敲除对小胶质细胞转录组的影响。识别Abi3基因敲除(Abi3−/−)小鼠中小胶质细胞亚群的变化,以及这些变化如何与AD相关的病理过程相互作用。
研究结果:
细胞聚类:通过scRNA-seq,研究者发现了基于特定标记基因表达的14个不同的细胞簇。
微胶质细胞亚群变化:在Abi3−/−小鼠中,特定的微胶质细胞亚群(如高表达Selplg的cluster 0和高表达Lilrb4a的cluster 1)比例发生了显著变化。
功能分析:Cluster 0基因主要涉及代谢相关途径,而Cluster 1基因涉及免疫反应途径,这支持了ABI3在神经炎症中的作用。
疾病相关微胶质细胞(DAM)标记基因:在scRNA-seq数据中,研究者分析了与DAM表型相关的标记基因的表达,发现Abi3−/−小鼠中DAM表型更为显著。
其他细胞类型标记基因:研究还检测了T细胞和B细胞标记基因,以确认细胞类型的特异性。
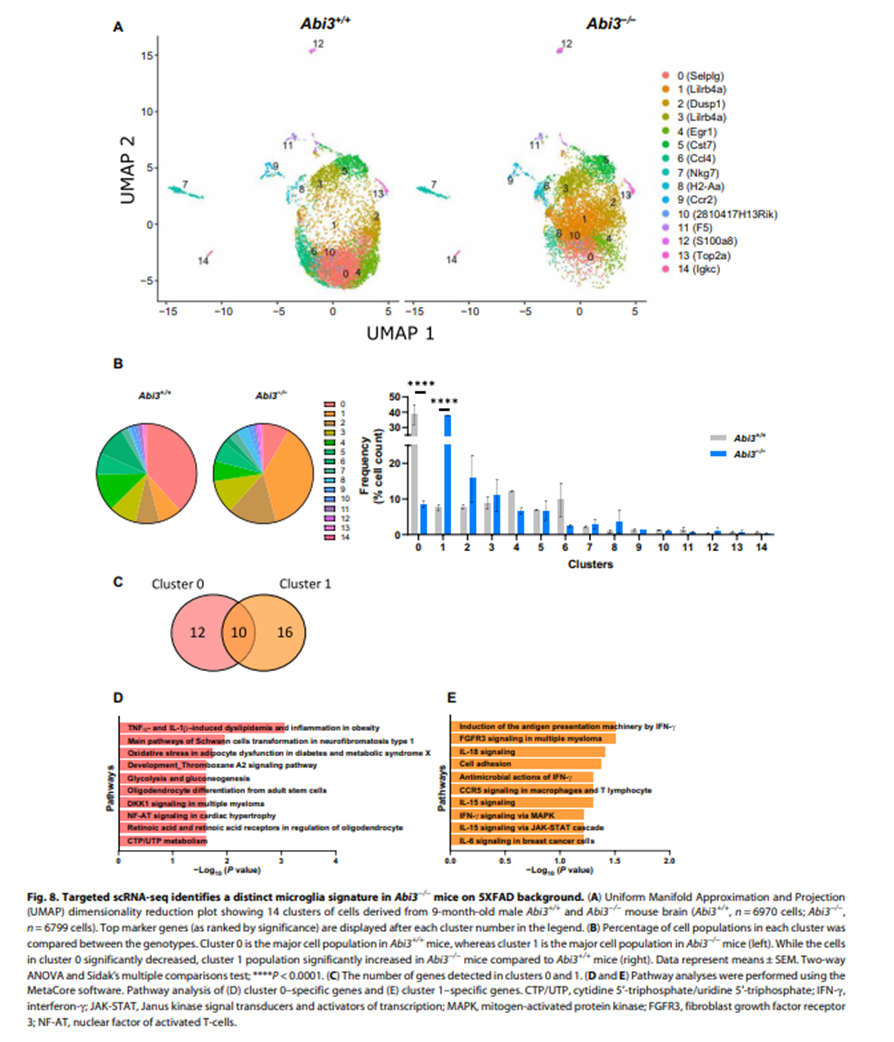
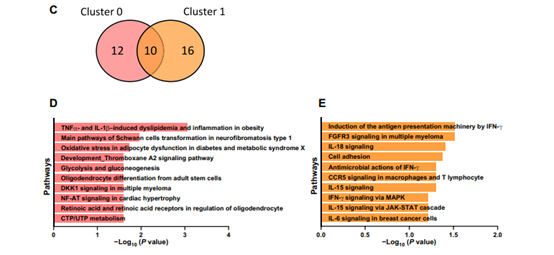
结论:scRNA-seq分析揭示了Abi3基因敲除导致5XFAD小鼠模型中微胶质细胞亚群的显著变化,这些变化与免疫反应和神经炎症途径有关,可能对AD的病理过程有重要影响。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


