Hello,各位小伙伴八月好啊,盛夏来临,酷暑难耐,各位都要注意防暑防晒,注意补充水分。关于人和小鼠的单细胞和空转的分析给大家分享了很多了,今天给大家分享几篇在其他动物中的单细胞或空转的研究。
首先分享的这篇是2024年四月发表在《Advanced Science》的《Integrating Single-Cell and Spatial Transcriptomics Reveals Heterogeneity of Early Pig Skin Development and a Subpopulation with Hair Placode Formation》。
皮肤是人体最大的器官,具有保护、调节体温、代谢和感觉等多种功能。然而,由于人类皮肤(尤其是胎儿皮肤)在研究复杂先天性皮肤遗传疾病方面的稀缺性和伦理问题,研究者们常常转向哺乳动物、啮齿动物和爬行动物作为替代品。然而,大多数动物的皮肤与人类皮肤在解剖结构上存在显著差异。例如,老鼠、兔子等非灵长类动物的表皮较薄,真皮结构松散,血管系统不发达,伤口愈合时表现出收缩性。研究发现,猪皮肤在解剖学和生理学上与人类皮肤非常相似,是皮肤学研究中常用的替代品。接下来我们简单的介绍下文中的几个发现。
1.1 猪胎儿皮肤的单细胞和时空转录组图谱
作者在以下四个时间点从七只猪胎儿中采集了皮肤活检样本:E37(诱导前)、E41(诱导)、E52(器官发生)和E85(细胞分化)。这些活检样本用于表型识别和单细胞RNA测序(ScRNA-seq)。表型识别结果显示三只猪为正常,三只为无毛,一只结果不明确(未知)。从活检样本生成的ScRNA-seq数据显示,每个样本捕获了17143至18238个基因(见支持信息表S1)。经过质量控制和整合,最终保留了七个样本中的51871个单细胞用于进一步分析。在Space Ranger(空转ST定量工具)生成的输出中,8367个spots被认为适合后续的整合分析。
为了阐明皮肤形态发生过程中的细胞异质性,作者首先进行了基于图的聚类,并根据人类和小鼠研究中报道的经典细胞类型标志基因对每个细胞群进行注释。最终识别了25个细胞群,对应于七个主要的细胞谱系分支,且显著富集了标志基因。在这七种细胞类型中,正常猪和无毛猪组中真皮和表皮细胞类型的比例在不同时间点是一致的,其中表皮细胞(比例最大)的比例在E41之前首先增加,然后减少,表明表皮发育在E41时可能经历了一个重大事件。作者使用免疫荧光(IF)分析验证了人类和小鼠的表皮(KRT14+和KRT15+)和真皮(COL1A1+和PTN+)标志基因。单细胞测序和IF结果高度一致,确认了单细胞数据准确注释。
接下来作者在ST(空间转录组)中识别了六种主要细胞类型。图1-1D显示了这些ST生成的细胞类型的空间分布,与皮肤组织结构一致,并突出了真皮和表皮的明显分界线。各种细胞类型,包括免疫细胞、内皮细胞、周细胞和施旺细胞,分散在真皮层中。真皮层展示了最广泛的皮肤组织分布,突显了其丰富性(图1-1D)。这一观察结果与ScRNA-seq结果一致,后者显示真皮在大多数情况下占多数(约70%;图1D;)。此外,ScRNA-seq捕获的七种细胞类型在高分辨率空间图中准确映射到各自的组织位置(图1-1D)。这种映射显示了ScRNA-seq和ST数据之间的细胞类型注释的一致性。此外,相关性分析显示了ScRNA-seq和ST共同识别的常见细胞类型的转录组之间的高度一致性(图1E)。

图1-1 猪胎儿皮肤的单细胞和空间转录组分析
1.2 猪表皮相比于小鼠表皮更能代表人类表皮
接下来作者将猪的单细胞转录组数据与小鼠和人的单细胞转录组数据进行整合分析来证明这个结论(图1-2)。每个物种的独立基于图的聚类显示,人类、小鼠和猪在主要皮肤细胞类型上具有保守性,包括真皮、表皮、内皮细胞、施旺细胞、周细胞和免疫细胞(图1-2B)。在UMAP中绘制这些细胞类型,显示出三种物种中相同细胞类型的大范围重叠分布,表明基因表达在不同生物体之间的保守性(图1-22A)。此外,在真皮、内皮和施旺细胞中,小鼠和人类的细胞类型特异性标志基因表现出更大的保守性。相反,在表皮、免疫系统和周细胞中,猪表现出更多保守的细胞类型特异性标志基因(图1-2C)。这支持了先前研究的发现,即猪表皮比小鼠表皮更能代表人类表皮。图1-2D显示了经典的皮肤细胞类型标志基因允许跨物种比较。在表皮(KRT15+和EPCAM+)和真皮(DCN+和COL1A1+)中的标志基因在所有三个物种中表现出一致的表达模式。相反,某些标志基因如KRT14+仅在某些物种中被检测到并标记上皮细胞(小鼠和猪),KRT5+标记上皮细胞(人类和猪),VWF+标记内皮细胞(人类和猪)。至于猪-人保守的细胞类型特异性基因,PheGWAS探索反映这些基因与人类皮肤相关疾病密切相关(图1-2E)。总体而言,与这里研究的其他动物模型相比,猪皮肤更能代表人类皮肤,表明使用猪皮肤模型研究皮肤相关复杂疾病更准确。

图1-2 人类、小鼠和猪的跨物种细胞图谱
1.3 表皮细胞谱系的亚群分析
接下来作者提取了表皮细胞谱系进行亚群聚类和拟时序分析。根据经典细胞类型标志基因的表达,共注释出九个亚型(图1-3A、B)。图1-23C展示了每个样本中表皮的九个细胞亚型的比例。值得注意的是,OGN+/UCHL1+细胞主要存在于E37U,而从E41到E52,毛囊间表皮(IFE)基底细胞和祖细胞的比例增加。正常组和无毛组之间的不同表皮亚型的比例没有显著差异。然而,在簇0和1中检测到的差异表达基因表皮层发育的调控有关。拟时序轨迹分析将表皮细胞分为两个细胞谱系分支上的五个发育状态(图1-3D)。细胞的拟时序排序也反映了采样时的发育时间点(E37主要位于状态1的初始位置,E85(N和H)在状态5,E41(N和H)和E52(N和H)在轨迹的中段(图1-3D的饼图)。此外,状态1主要由OGN+/UCHL1+细胞(簇4)组成,而状态5主要由分化的KRT-和IFE相关细胞(簇0、5、7和8)组成,在正常组和无毛组中均如此(图1-3E)。
细胞分化的分支点分析表明:分支点1,代表OGN+/UCHL1+细胞向前DC和IFE基底细胞(状态2和3)的分化(图1-3F),作者确定了在分支点两侧随细胞拟时序排序显著差异表达的基因。根据这些基因的差异表达模式,作者识别了四个基因簇,这些基因簇在OGN+/UCHL1+细胞与前DC细胞的分化路径上表现出高度一致的基因表达动态。这些表达模式表明OGN+/UCHL1+细胞是皮肤发育的早期祖细胞。与分支点1的分析类似,结果表明分支点2与成熟Pc(hair placode,毛囊基板)发育和HF(hair follicles,毛囊)形态发生(状态4)相关,而KRT分化(状态5)发生在交替的细胞命运上,表明存在共同的祖细胞(图3G)。最后,在HF形态发生的不同阶段使用经典标志基因进行了免疫荧光(IF)验证。结果显示,LEF1和SOX9与HF标志基因在空间上共表达,与ScRNA和ST结果一致(图1-4)。
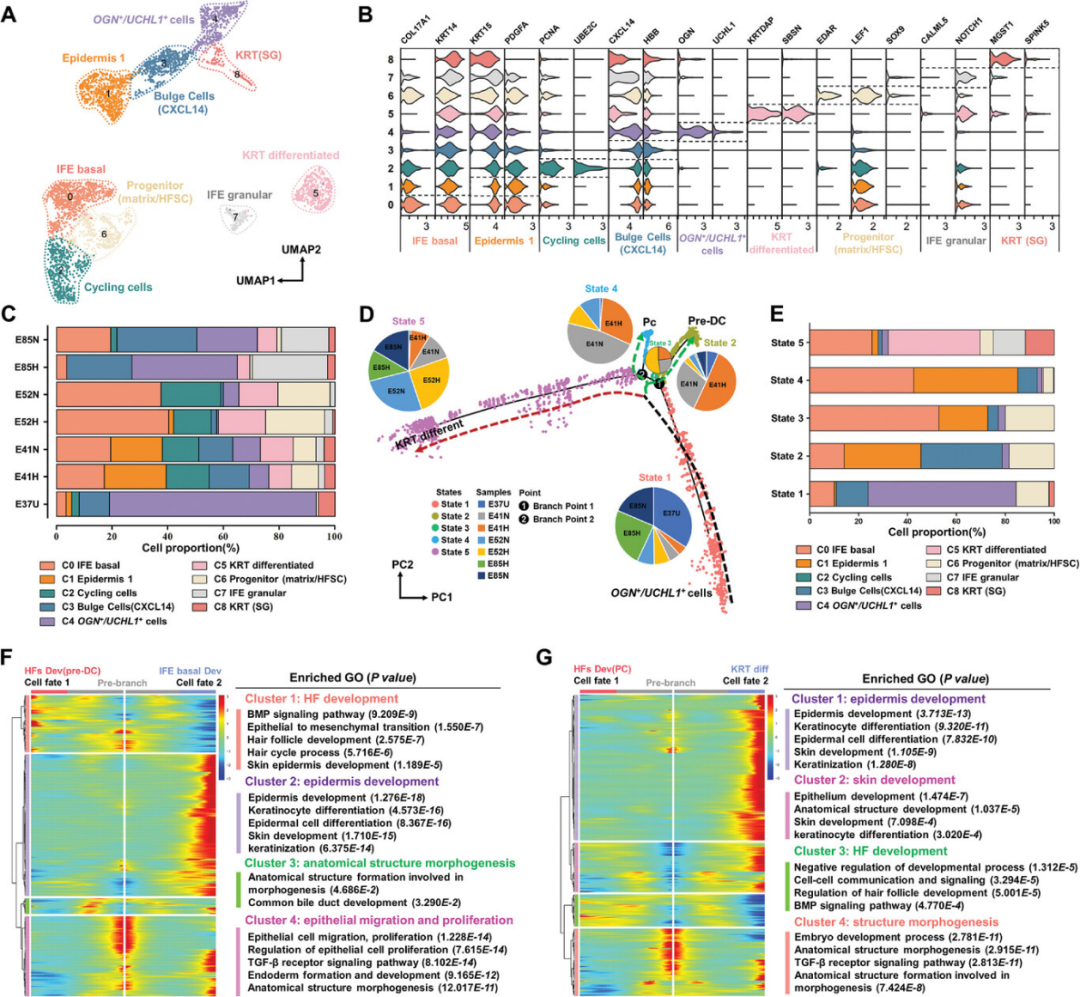
图1-3 皮肤发育过程中表皮细胞命运的决定概览

图1-4:经典 HF 标记表达的可视化
接下来作者使用了类似的拟时序分析方法研究胚胎阶段真皮成纤维细胞异质性的起源,根据先前报道的乳头状成纤维细胞 (APCDD1)、网状成纤维细胞 (COL11A1) 和成纤维细胞祖细胞的标记物,确定了真皮成纤维细胞起源的细胞身份。
1.4 早期毛囊发展中毛囊基板的起源
在正常猪中,Pc的形成发生在E37(诱导前)到E41(诱导);相比之下,无毛猪缺乏Pc细胞。作者假设在无毛猪中Pc的形成是异常的。为了验证这一假设,作者首先应用CytoTRACE评估表皮细胞的干性评分。结果显示,从E41到E85,干性下降,而E37U中较低的干性可能归因于其与其他样本不同的细胞类型组成(图1-5A和1-3C)。特别是HF干细胞(HFSCs)的比例在E37到E41之间从0增加到近20%,并在E52保持不变,导致E37的干性低于E41和E52。在比较正常和无毛样本时,仅在E41观察到显著的干性差异(P = 4.96e-08)(图1-5A)。这些结果支持作者提出的假设,即无毛表型在HF形态发生过程(尤其是状态1细胞)中的E37和E41之间出现。作者分离了状态1中的所有细胞进行细粒度聚类和伪时间分析。这表明OGN+/UCHL1+细胞通过TC1向TC2(Pc形成)和TC3(上皮命运)形成两个分化分支(图1-5B,C)。对两个分支(OGN+/UCHL1+ →TC1→TC2 和 OGN+/UCHL1+→TC1→TC3)之间的差异表达分析表明,在细胞命运决策点,TGFβ和BMP信号通路富集,表明这些信号通路在调节HF形态发生中的重要性。使用Cell2location,首次确定了OGN+/UCHL1+细胞在E37时的空间定位。此外,研究揭示了在这一特定区域内激活的BMP和TGFβ信号通路。这一发现突显了OGN+/UCHL1+细胞的重要性及关键信号通路在空间模式中的作用。在E41时,正常和无毛猪之间OGN+/UCHL1+细胞和TC1的细胞比例没有明显差异(图6D)。虽然在正常样本的E41表皮中检测到Pc(TC2)细胞,但在无毛样本的E41中则大大减少(图1-5D)。
接下来,作者试图通过配体-受体(LR)细胞-细胞相互作用分析描述OGN+/UCHL1+向Pc细胞过渡的细胞信号机制。在OGN+/UCHL1+和TC1/2细胞之间观察到几种显著的LR相互作用,而在OGN+/UCHL1+和TC3细胞之间则较少。TC1与OGN+/UCHL1+细胞和TC2强烈相互作用(r > 0.2, p < 0.03),而在TC3与其他细胞亚型之间发现较弱的相关性(r < 0.2, p < 0.05)(图1-5E)。
此外,Pc形成早期的转录调控网络表明,OGN+/UCHL1+细胞参与的LR相互作用在生物过程“干细胞分化”、BMP和TGFβ信号通路中富集。在TC1中,LR对在“细胞增殖”和“细胞迁移”中富集,但这些只在正常样本中观察到,而在无毛猪中没有,表明细胞间信号传导差异引起的细胞行为可能是导致无毛猪Pc形成减少的原因。对于TC2,显著的LR相互作用在经典HF信号通路如WNT和NF-kB/EDA通路中富集。此外,作者使用其标志基因以及来自BMP和TGFβ信号通路的代表基因定位E37表皮组织中的OGN+/UCHL1+细胞(图1-5F)。这证实了空间样本中存在OGN+/UCHL1+细胞,并进一步支持了BMP和TGFβ信号在早期HF发育中的作用。
总的来说,作者的结果揭示了两个分化轨迹,一个是从OGN+/UCHL1+细胞→TC1→TC2导致正常的Pc形成,另一个是从OGN+/UCHL1+细胞→TC1→TC3导致上皮发育。进一步研究表明,OGN+/UCHL1+细胞在增殖和迁移中的异常导致无毛猪中Pc形成异常,并且BMP和TGFβ是触发OGN+/UCHL1+细胞进行Pc形成的首要信号通路。

图1-5:毛基板形成的分子机制和转录调控网络
除了猪的单细胞研究之外,其他动物的单细胞研究近几年也有不少发表。例如发表在《Int J Mol Sci.》的两篇关于牦牛的单细胞研究,分别研究了牦牛的卵巢和睾丸细胞图谱。并且这两篇文章出自同一实验室。
2:牦牛睾丸的单细胞图谱
《Single-Cell RNA Sequencing Reveals Atlas of Yak Testis Cells》这篇文章介绍到精子生成是一个复杂的过程,涉及二倍体雄性生殖细胞增殖和分化为单倍体鞭毛精子,并需要睾丸体细胞和生殖细胞之间的复杂相互作用。这个过程的细胞异质性使得分析不同发育阶段的不同细胞类型时带来了挑战。单细胞RNA测序(scRNA-seq)提供了探索细胞异质性的重要工具。在本研究中,作者利用单细胞测序对性成熟的4岁牦牛精子生成进行了全面和无偏的单细胞转录组研究。scRNA-seq分析鉴定了牦牛睾丸中的六种体细胞类型和各种生殖细胞,包括精原干细胞、精原细胞、早期精母细胞、晚期精母细胞和精子细胞。拟时序分析显示,牦牛的睾丸间质细胞和肌样细胞起源于共同的祖细胞。此外,功能富集分析表明,牦牛睾丸体细胞中高表达的基因显著富集在cAMP信号通路、PI3K-Akt信号通路、MAPK信号通路和ECM受体相互作用中。在整个精子生成过程中,表达了与精子生成、细胞分化、DNA结合和ATP结合相关的基因。通过免疫组化作者鉴定出了精原干细胞和支持细胞的候选标志基因。研究为牦牛精子生成及睾丸中各种细胞类型的发育提供了新的见解,并为后期体外培养和鉴定牦牛精原干细胞提供了更可靠的标志蛋白。
在细胞鉴定方面,作者根据每个簇中表达的基因以及已知的人类、小鼠和其他动物的通用标志基因,鉴定了每个簇的细胞类型。作者的研究结果表明,牦牛的睾丸细胞可以分为19个簇,包括4个生殖细胞簇和13个体细胞簇(图2-2A)。发现簇9和17中的细胞表达精原细胞(SPG)标志基因UCHL1和TKTL1(图2-2B)。发现簇12中的细胞表达精母细胞(SPC)标志基因SYCP1、MEIOB、SYCP2、SYCE1、DMRTC2、ZPBP和SPATA16(图2C,D,补充图S1B-F)。簇13中的细胞表达精子细胞(SPT)标志基因ZPBP、ACRV1、ACTL7B、HOOK1、TEX35、CAPZA3、HEMGN、TEX29和SPATA19(图2-2D,E)。簇18中的细胞表达支持细胞(SC)标志基因SOX9和WFDC2(图2-2F)。簇6和15中的细胞表达内皮细胞(EC)标志基因VWF、CD34和PALMD(图2-2G)。簇14中的细胞表达巨噬细胞标志基因C1QA和CSF1R(图2-2H)。簇4、10、11和16中的细胞表达睾丸间质细胞/肌样细胞(LC/MC)标志基因CYP11A1、IGFBP5、INHBA、LGALS3、ACTA2、MYH11、TAGLN和FHL2(图2-2I-K)。簇1、2、7、8和19中的细胞表达T淋巴细胞/自然杀伤细胞(T/NK)标志基因NKG7(图2-2L)。本研究成功鉴定了牦牛精子发生中的主要细胞类型(图2-2M)。
接下来作者以这些细胞类型为基础进行了生殖细胞的再分群,marker基因鉴定,功能富集等分析来解析了牦牛睾丸的细胞图谱。

图2-1 牦牛睾丸组织切片的组织学观察

图2-2 牦牛睾丸组织细胞的聚类分析及细胞类型鉴定
3:牦牛卵巢的单细胞图谱
《Single-Cell Transcriptomics Analysis Reveals a Cell Atlas and Cell Communication in Yak Ovary》这篇文章提到牦牛(Bos grunniens)是唯一能很好适应青藏高原恶劣高海拔环境的牛属物种。然而,牦牛对高海拔气候的生殖适应机制尚未阐明。细胞组成和分子特征是正常卵巢功能的基础,决定了生殖性能。由此引出在细胞分子水平上描绘卵巢特征有助于阐明牦牛生殖适应的机制。在本研究中,作者采用单细胞RNA测序(scRNA-seq)描绘了牦牛卵巢中具有特定分子特征的不同细胞类型的图谱。细胞类型是根据其特定表达的基因和生物功能进行鉴定的。结果成功建立了包含卵泡膜细胞、基质细胞、内皮细胞、平滑肌细胞、自然杀伤细胞、巨噬细胞和增殖细胞的牦牛卵巢细胞图谱。构建了不同细胞类型之间的细胞间通信网络。根据其生物功能,卵泡膜细胞被分为五个亚型。此外,通过免疫荧光染色确认了CYP11A1是卵泡膜细胞的标志基因。研究揭示了细胞分子水平的卵巢图谱,有助于提供牦牛生殖适应的见解。
基于PCA空间中的欧几里得距离构建了K近邻图。使用UMAP在二维图中可视化细胞簇。所有卵巢细胞被分为17个细胞簇(图3-1A),从每个簇中按调整后的p值(Wilcoxon秩和检验)筛选出前30个差异表达基因(DEGs)。不同簇中代表性基因的表达水平和比例在点矩阵中可视化(图3-1B),显示除簇7外,每个簇都有其特异性表达基因。每个簇的前五个变量基因的表达特异性在热图中显示(图3-1C)。
由于singleR注释方法不适合牦牛,作者基于每个簇的特异性表达基因及其生物功能进行了手动注释。然后,将17个簇成功注释为8种细胞类型,包括卵泡膜细胞(一个簇,4.62%)、基质细胞(五个簇,32.39%)、内皮细胞(两个簇,21.69%)、平滑肌细胞(一个簇,1.69%)、自然杀伤细胞(四个簇,29.97%)、巨噬细胞(一个簇,1.40%)、增殖细胞(两个簇,2.20%)和未知细胞(一个簇,6.04%)(图3-2A)。每种细胞类型和每个簇中的细胞数量在气球图中展示(图3-2B)。从每种细胞类型中按调整后的p值筛选出前30个差异表达基因。不同细胞类型的标志基因的表达分数和比例在点矩阵中可视化(图3-2C),显示除未知细胞外,每种细胞类型都有其特异性表达基因。每种细胞类型六个代表性差异表达基因的特异性表达在热图中展示(图3-2D)。大多数差异表达基因在其自身的细胞类型中特异性表达。每种细胞类型标志基因的平均表达水平在热图中显示(图3-3A)。八个细胞类型特异性标志基因的表达特征在UMAP图中展示,包括CCL5、PECAM1、FBLN1、RPL18A、CYP11A1、RGS5、CENPF和AIF1(图3-3B)。如图所示,所有标志基因在对应的细胞类型中表现出表达特异性,除RPL18A外,该基因在所有细胞类型中高表达。
接下来作者基于细胞类型注释进行了不同细胞类型的marker鉴定与通路注释,卵巢细胞之间的细胞通讯及拟时序分析,以此来详细解析了牦牛卵巢的细胞图谱。

图3-1牦牛卵巢细胞簇及其特征基因特征

图3-2:牦牛卵巢细胞类型及其基因特征
结论:由上面文章可以看出,研究这类非人、鼠的动物物种时,往往可以专注于研究一类组织类型,对其进行深刻的分析与刻画。在分析方面可以以细胞图谱为切入点做的简单些,也可以结合实际科学问题进行详细的研究。












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


