尿路感染通常由尿路致病性大肠杆菌(UPEC)导致,给全球医疗保健系统带来了沉重负担。由于UPEC菌株对抗生素的抗药性日益增加,传统方法治疗尿路感染变得越来越具有挑战性。尽管对UPEC引起的宿主免疫应答进行了深入研究,但在UPEC感染期间膀胱上皮细胞与巨噬细胞之间的通信机制仍很大程度上未被探索。
本文研究结果表明,在UPEC感染期间,由膀胱上皮细胞释放的外泌体可能驱动过度先天免疫细胞激活导致的膀胱组织破坏。此外,通过药物抑制上皮细胞释放的外泌体在小鼠UPEC感染性膀胱炎模型中限制了巨噬细胞相关的炎症、先天免疫细胞浸润以及组织病理损伤。因此,研究结果表明调控外泌体释放可能是一种有前景的非抗生素治疗尿路感染的方法。
本文Exosomes derived from bladder epithelial cells infected with uropathogenic Escherichia coli increase the severity of urinary tract infections (UTIs) by impairing macrophage function发布于《PLoS Pathog.》。该研究使用了LabEx提供的多因子检测服务,共检测了23种因子。
巨噬细胞在体外和体内同化膀胱上皮细胞分泌的外泌体
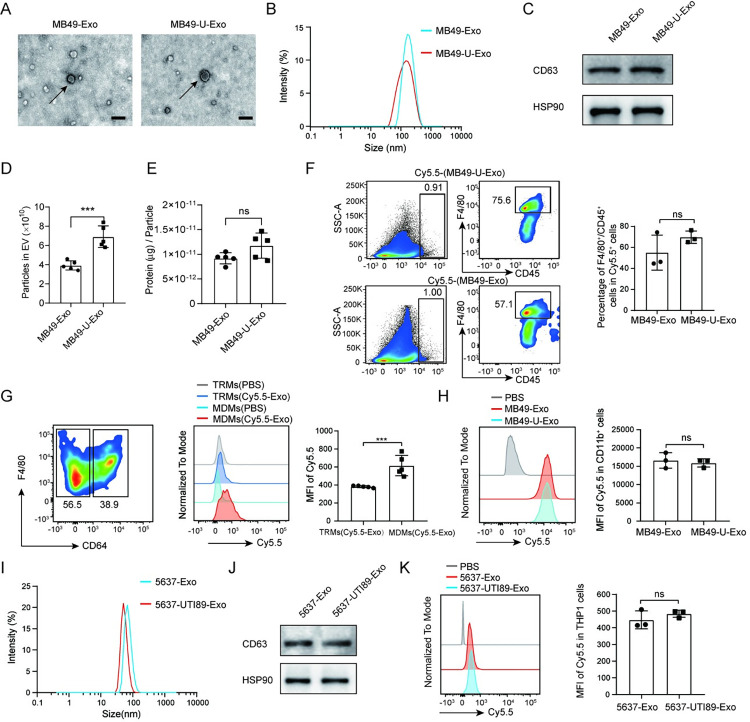
透射电子显微镜证实,未感染(MB49-Exo)或UPEC感染(MB49-U-Exo)的MB49细胞产生的外泌体具有典型的杯状形态(图1A)。此外,还使用粒度分析和WB分别评估了外泌体的粒度分布以及外泌体标记物CD63和HSP90的蛋白表达(图1B和1C)。
通过透射电子显微镜、颗粒大小分析和免疫印迹等技术手段,确认了外泌体的形态特征和标记物的表达。通过从小鼠膀胱上皮细胞系MB49培养液中分离外泌体,研究发现在UPEC感染后,膀胱上皮细胞释放的外泌体数量显著增加。使用流式以及荧光标记技术,研究进一步发现了这些外泌体被巨噬细胞吸收。这部分实验证明,UPEC感染可以增加膀胱上皮细胞释放的外泌体数量,而这些外泌体会在体内或体外被巨噬细胞吸收。
MB49-U-Exo会加剧UPEC引起的膀胱炎
研究接着评估了MB49-U-Exo对UPEC感染引起的膀胱炎症的潜在影响。通过在小鼠中建立UPEC感染诱导的膀胱炎症模型(图2),研究发现在UPEC感染后的2天,MB49-U-Exo组中的F4/80+CD11b+巨噬细胞和CD11b+Ly6G+中性粒细胞数量显著高于MB49-Exo组。此外,MB49-U-Exo预处理加剧了小鼠的膀胱炎症病理,表现为浸润上皮和亚上皮炎症细胞的百分比显著增加,以及与MB49-Exo或PBS预处理的小鼠相比(图2B和2C),组织病理评分的显著增加(图2D)。这些数据表明,MB49-U-Exo处理增强了对UPEC感染的天然炎症反应,导致组织破坏。

MB49-U-Exo诱导巨噬细胞分泌促炎细胞因子
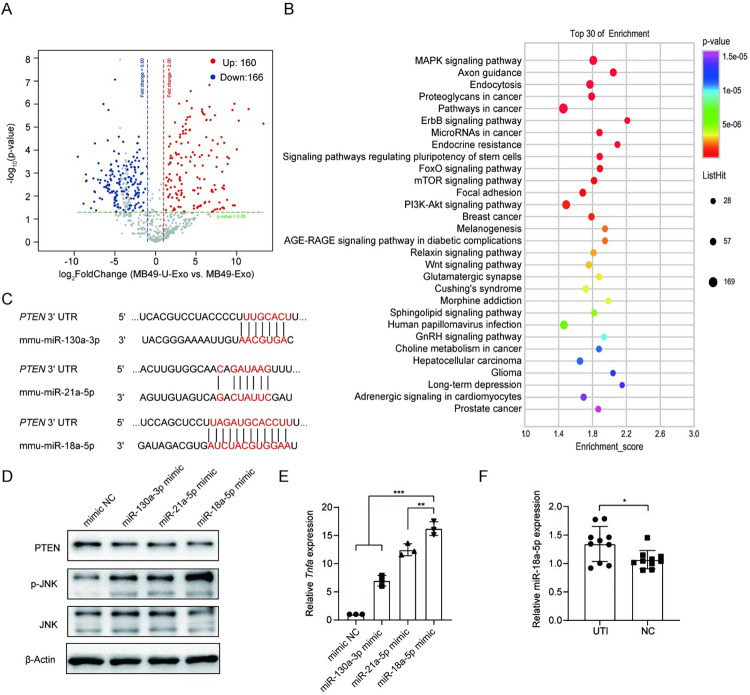
为了进一步探索MB49-U-Exo处理对UPEC感染诱导的膀胱炎症加剧的分子机制,研究者将巨噬细胞与MB49-U-Exo处理。通过测量细菌内毒素活性,排除了在分离过程中的脂多糖(LPS)污染的可能性,并确认MB49-U-Exo和MB49-Exo均具有低内毒素活性。随后,对暴露于MB49-U-Exo或MB49-Exo的骨髓来源的巨噬细胞(BMDMs)进行了RNA测序分析,发现MB49-U-Exo处理与MB49-Exo处理相比,共有1311个差异表达基因(DEGs;其中828个上调,483个下调),通过对上调的DEGs进行科全书(KEGG)分析,结果显示这些基因参与了与传染性疾病和免疫系统相关的通路。
在DEGs中,多个炎症基因(例如Tnf、Il6、Cxcl10和Ccl4)显著上调,而与吞噬作用相关的多个基因(例如Axl、Mertk、Appl2、Clec7a)在MB49-U-Exo处理的BMDMs中显著下调(图3A和图3B)。基因集富集分析(GSEA)证实MB49-U-Exo处理上调了参与BMDMs中TNFα信号通路的基因(图3C).。一致地,细胞因子检测(LabEx提供)分析证实MB49-U-Exo促进了巨噬细胞分泌炎症因子和趋化因子(例如TNFα、CXCL10、IL-6、CCL5、CXCL1、CCL24和CCL4)(图3D)。研究发现,在MB49-U-Exo处理的BMDMs中,促炎因子TNFα的表达在mRNA和蛋白水平上均显著高于对照组(图3E和3F)。类似地,5637细胞感染536或UTI89 UPEC菌株产生的外泌体也诱导了THP1细胞中TNFα的表达(图3G).。研究者接下来探讨了来自患有UPEC感染性膀胱炎的小鼠尿液的外泌体是否能够调控巨噬细胞中TNFα的表达。WB检测CD63和HSP90用于确认成功从尿液中分离出外泌体。如预期一样,与使用来自PBS处理的动物或PBS处理的尿液的外泌体相比,使用从UPEC感染的小鼠尿液中分离的外泌体处理的BMDMs中TNFα的表达显著增加(图3I).。

MB49-U-Exo通过激活MAPK/ERK/JNK通路诱导巨噬细胞产生TNFα
研究者接下来试图探索上述过程中涉及的信号通路。MB49-U-Exo处理与MB49-Exo处理的GSEA分析表明JNK信号通路参与更显著(图4A)。有趣的是,MB49-U-Exo处理后磷酸化的ERK和JNK水平显著增加,表明MB49-U-Exo引起了MAPK/ERK/JNK信号通路的激活(图4B)。为了进一步确定ERK/JNK激活对TNFα表达的影响,研究者使用ERK抑制剂PD98059或JNK抑制剂SP600125对BMDMs进行了预处理。他们发现PD98059处理显著减少了MB49-U-Exo诱导的ERK激活以及TNFα分泌(图4C),而SP600125处理对TNFα产生具有更强的抑制作用(图4D和4E)。这些发现表明MB49-U-Exo通过激活MAPK/ERK/JNK信号通路诱导BMDMs产生TNFα。

MB49-U-Exo通过自分泌TNFα引发巨噬细胞凋亡
TNFα在细胞凋亡、炎症和免疫中起着关键作用,因此下一步是研究MB49-U-Exo处理是否诱导巨噬细胞凋亡。事实上,研究者观察到用MB49-U-Exo处理的BMDMs的凋亡率明显高于用MB49-Exo或PBS处理的BMDMs(图5A)。此外,使用TNFα中和抗体可显著降低MB49-U-Exo诱导的细胞凋亡程度(图5B),这表明TNFα在巨噬细胞暴露于MB49-U-Exo后起到了促凋亡的作用。
MB49-U-Exo可抑制巨噬细胞的吞噬活性
在确定了MB49-U-Exo诱导BMDMs凋亡并抑制吞噬相关基因表达后,研究者随后调查了它们对巨噬细胞吞噬活性的影响。与MB49-Exo预处理相比,MB49-U-Exo预处理显著减弱了BMDMs的吞噬活性(图5C和5D)。同样,在MB49-U-Exo暴露后,BMDMs吞噬活UPEC的能力降低(图5E–5G)。此外,在UPEC诱导的膀胱炎小鼠模型中,MB49-U-Exo预处理的膀胱F4/80+CD11b+巨噬细胞吞噬的EGFP-UPEC相比对照组较少(图5H)。因此,MB49-U-Exo组小鼠膀胱中的UPEC滴度比MB49-Exo组小鼠高得多,表明MB49-U-Exo减弱了体内巨噬细胞的吞噬能力(图5I)。为了进一步评估外泌体对巨噬细胞吞噬的影响,研究者在Transwell室中共培养BMDMs和MB49细胞,通过400纳米过滤器将它们隔离开,仅允许外泌体通过(图5J)。外泌体分泌抑制剂GW4869或TNFα中和抗体部分恢复了MB49-U-Exo处理的BMDMs吞噬大肠杆菌生物颗粒的能力(图5K)。使用THP1细胞与GW4869或TNFα中和抗体infliximab联合处理5637-U-Exo或5637-Exo也得到了类似的结果。

抑制MB49-U-Exo-介导的TNFα生成可减轻UPEC引起的体内膀胱炎
研究者接下来探究了阻断外泌体分泌或中和TNFα活性是否能改善UPEC诱导的膀胱炎。与未处理组相比,接受GW4869或TNFα中和抗体治疗的UPEC诱导的膀胱炎小鼠的膀胱中巨噬细胞和中性粒细胞的数量显著较低(图6B,6C)。GW4869和TNFα中和抗体组的组织病理评分显著低于仅UPEC组,表现为较低数量的浸润的上皮/下上皮炎症细胞和表面上皮的恢复(图6B–6E)。除了恢复BMDMs的吞噬能力外,研究者还表明给药增加了巨噬细胞对细菌的摄取(图6F)。因此,在GW4869和TNFα中和抗体治疗组的小鼠膀胱中,UPEC滴度显著低于仅UPEC组的小鼠膀胱(图6G)。这些发现表明,阻断UPEC介导的外泌体分泌或TNFα产生通过恢复巨噬细胞吞噬活性促进了UPEC的清除。

MB49-U-Exo通过传递miR-18a-5p诱导JNK激活和TNFα生成
通过显示抑制TNFα产生减轻了UPEC诱导的膀胱炎的严重程度,研究者接下来调查了MB49-U-Exo中哪些因子诱导了巨噬细胞产生TNFα。由于miRNA(外泌体中的一个重要载体)在基因表达调控中起着关键作用,研究者通过对MB49-U-Exo和MB49-Exo的miRNA测序鉴定了在MB49-U-Exo中富集的326个miRNA(图7A)。KEGG通路分析显示,被最显著富集的miRNA靶向的基因与MAPK信号通路相关(图7B)。研究者使用TargetScan数据库确定在MB49-U-Exo中最显著富集的miRNA(即miR-130a-3p、miR-21a-5p和miR-18a-5p)中是否有靶向PTEN的miRNA;这些候选miRNA的潜在PTEN结合位点显示在图7C中。只有miR-18a-5p模拟物减少了BMDMs中的PTEN表达并激活了JNK信号传导(图7D)。此外,用miR-18a-5p模拟物处理BMDMs显著上调了它们的TnfαmRNA表达(图7E)。尽管miR-130a-3p和miR-21a-5p稍微增加了BMDMs中的TNFα表达,但这两种miRNA都对这些细胞中PTEN表达或JNK激活没有显著影响。此外,与健康对照组尿液中的外泌体相比,UTI患者尿液中miR-18a-5p的水平显著更高(图7F)。这些数据表明,封装在MB49-U-Exo中的miR-18a-5p可能在诱导巨噬细胞产生TNFα方面起着主要作用,并可作为诊断尿路感染的潜在生物标志物。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


