动脉粥样硬化是心血管疾病的主要病因之一,它是指中等动脉或大动脉的动脉壁形成脂质斑片状沉积物(粥样斑或粥样硬化斑块),导致血流量减少或阻塞血液流出
体内成像,细胞谱系追踪,mRNA测序等方法都揭示了T 细胞作为动脉粥样硬化发病机制的关键驱动因素和调节因素的作用。这篇综述总结了T细胞亚群在动脉粥样硬化中的功能以及T 细胞归巢到动脉粥样硬化斑块的过程。
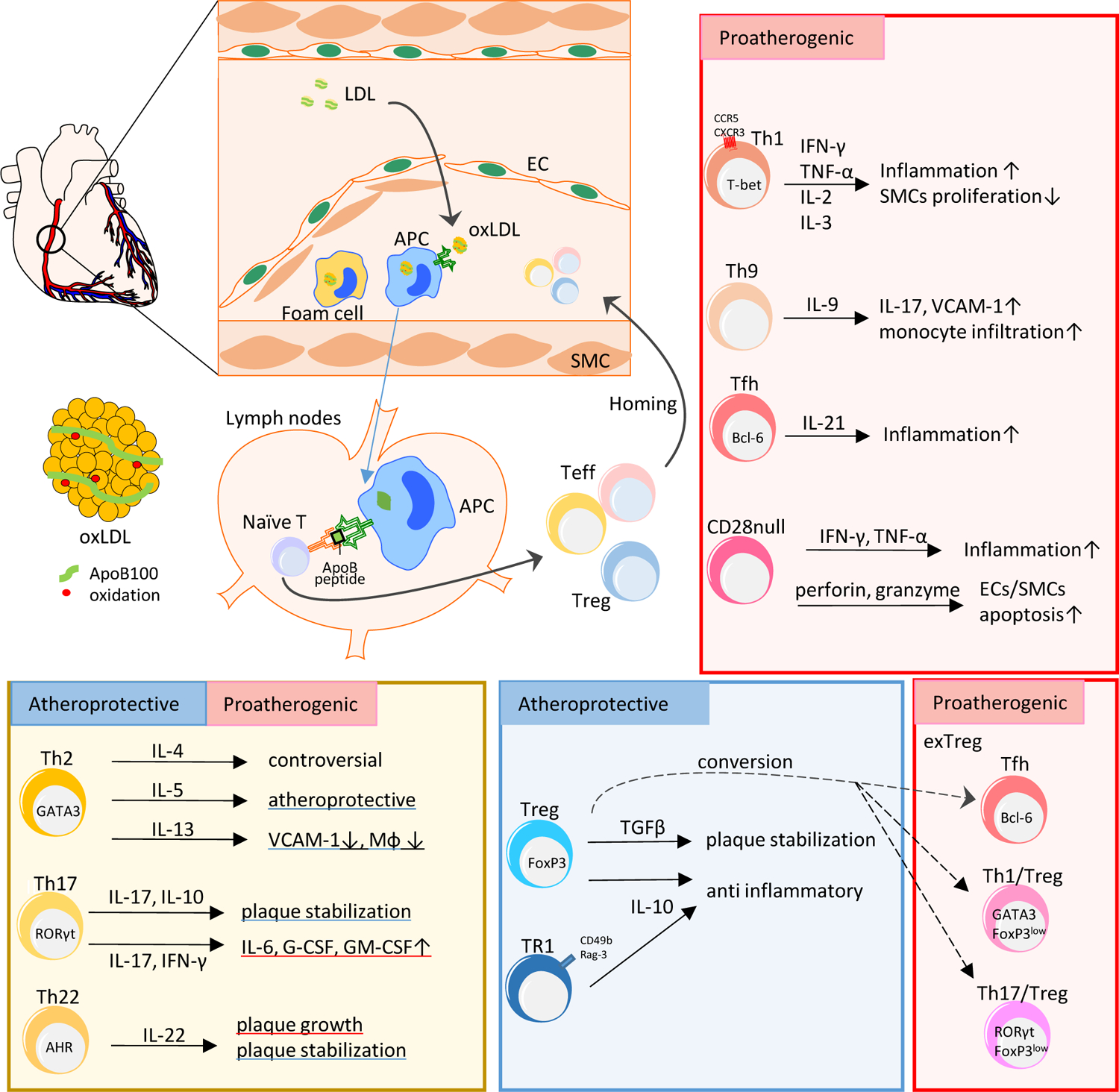
上图总结了T 辅助细胞和调节性T细胞在动脉粥样硬化发病机制中的作用。这篇文章将基于该图和该篇文献展,为大家介绍部分参与动脉粥样硬化机制的CD4+T细胞。
抗原呈递细胞可以吸收和处理氧化的LDL(oxLDL),迁移至淋巴结,在MHCII内分子上呈递来自载脂蛋白B的肽。幼稚T细胞通过特定的TCR受体可以识别肽,共刺激分子诱导T细胞转录表达因子,帮助其分化为效应性T(Teff)细胞或调节性T(Treg)细胞。淋巴归巢受体可以促进这些T细胞迁移回动脉粥样硬化病灶处,并且分泌效应细胞因子。
多类T细胞以不同的角色参与动脉粥样硬化的机制:
Proatherogenic(促进动脉粥样硬化)
Th1:表达转录因子T-bet,包括CXCR3和CCR5在内的趋化因子受体,分泌IFNγ。多个研究支持Th1是最主要的引起动脉粥样硬化的TH亚群。IFNγ可以通过抑制血管平滑肌细胞生成,影响巨噬细胞计划和调控心血管疾病危险因素来降低斑块稳定性。尽管多种与TH1相关的促炎症细胞因子也在斑块中表达增加,但目前还无对它们的详细研究。
TH9:主要通过TGFβ和IL-4生产IL-9。心血管疾病患者中观察到IL-9的水平增高。IL-9会引起不稳定心绞痛患者和健康人的PBMCs的IL-17的分泌。研究提出IL-9可能通过诱导VCAM1在主动脉内皮细胞中的表达,介导炎症细胞浸润动脉粥样硬化病灶,以此促进动脉粥样硬化。在亚临床动脉粥样硬化患者中,也观察到FOXP3+T细胞中有相当一部分同时获得了Th17定义的转录因子RORγt或TH1相关转录因子T-bet的表达。
Atheroprotective(抑制动脉粥样硬化)
Treg:经典的Treg细胞亚群的特征是FOXP3蛋白,IL-2RA和CTLA4的表达。小鼠中,Treg具有保护作用,临床数据也表示出相同结果。Treg通过产生高水平的IL-10和TGFβ防止动脉粥样硬化,前者是抑炎因子,后者可以稳定斑块形成。但是FOXP3+Treg具有一定可塑性,随着动脉粥样硬化的发展,Treg细胞的免疫抑制表型会消失,转而使得一部分它们转化为表达BCL6的促动脉粥样硬化Tfh。
Tr1:主要通过分泌IL-10起到抑制动脉粥样硬化的作用。
Proatherogenic/ Atheroprotective(两者皆有)
Th2:Th2细胞参与对寄生虫的防御,参与哮喘和其他过敏性疾病。Th2的主要细胞因子是IL-4,但在小鼠斑块中,一部分的T细胞也会表达和TH2相关的其他细胞因子,如IL-5,IL-10和IL-13。但Th2到底是抑制还是促进动脉粥样硬化仍未明了,这也表现在IL-4的作用上。它在小鼠模型中可以消去病灶,但也有其他研究表示删去它无法减少动脉粥样硬化生成。相较之下,IL-5和IL-13主要起抗动脉粥样硬化作用。
TH17:这是一种具有可塑性的细胞,特征为表达转录因子PORC。TH17在不同的环境下可以表达促进(IL-6,GSF,趋化因子)或者抑制(IL-17,IL-10)动脉粥样硬化的炎症分子。
TH22:TH22会表达AHR,产生IL-22。TH22的作用也仍未明确,研究表明,急性冠状动脉综合征患者的TH22细胞的循环水平增加,动脉粥样硬化患者血浆中的IL-22水平也更高。IL-22可能通过刺激内侧VSMC分化为合成表型而参与激活血管修复,促使VSMC迁移到内膜中,引起斑块生长。但也有证据指出它可以通过抑制肠道微生物群减少动脉粥样硬化。







 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


